論文信息

論文标題:A gut microbiota-bile acid axis promotes intestinal homeostasis upon aspirin-mediated damage
腸道微生物-膽汁酸軸在阿司匹林介導的損傷中促進腸道内環境平衡
期刊名稱:Cell Host Microbe
影響因子:30.3(IF2023)
論文分區:中科院1區TOP;JCR Q1
發文時間:2024.01.17(出版)
D O I 号: 10.1016/j.chom.2023.12.015
第一單位:西安交通大學第一附屬醫院心血管内科
導讀


2024年1月17日,西安交通大學第一附屬醫院心血管醫學科吳嶽、袁祖贻教授團隊,與美國國家衛生研究院癌症研究中心Frank J. Gonzalez教授團隊合作,于《細胞宿主與微生物》(Cell Host Microbe)在線發表了題爲“A gut microbiota-bile acid axis promotes intestinal homeostasis upon aspirin-mediated damage”的研究論文。該研究闡釋了一種腸道微生物金氏拟杆菌(P. goldsteinii)及其代謝物7-酮-立洛酮酸(7-keto-LCA)通過抑制膽汁酸受體FXR并維持腸道幹細胞Wnt信号維持腸道穩态,而阿司匹林抑制金氏拟杆菌的生長,從而誘發腸損傷。
研究背景

由于阿司匹林的鎮痛和潛在的抗腫瘤作用,已成爲目前最常用的藥物之一。多年來,阿司匹林的不良反應,如胃腸道損傷,一直引起人們的關注。值得注意的是,最近的報告表明,超過90%的服用阿司匹林的患者出現腸道毒性。阿司匹林誘導腸道損傷的機制已受到相當多的關注,但仍存在争議。阿司匹林抑制前列腺素内過氧化物合成酶1 (PTGS1)或環加氧酶(COX1和COX2),這兩類酶被認爲會介導胃腸道損傷。然而,進一步的研究發現,這些酶的抑制似乎不是阿司匹林相關腸病的唯一機制。此外,阿司匹林是一種口服藥物,可被小腸吸收,且在小腸的濃度達到最高。因此,不能排除阿司匹林的不良反應可能部分是由于腸道微生物群的改變。
最近有報道顯示,阿司匹林治療與腸道菌群組成的改變有關。然而,哪些腸道微生物群會受到阿司匹林的影響,以及介導阿司匹林對宿主腸道穩态影響的潛在機制仍不清楚。越來越多的證據表明,腸道微生物群通過調節膽汁酸 (BA) 等代謝物影響腸道穩态和腸道幹細胞功能,而腸道幹細胞對于維持腸道屏障至關重要。多項研究表明,腸道菌群産生的 BA 在調節腸道幹細胞的擴增、分化和自我更新方面發揮着關鍵作用。例如,法尼脂X受體 (FXR) 等BA受體在協調腸道幹細胞響應損傷的更新和再生方面發揮着重要作用。然而,目前尚不清楚阿司匹林相關的腸道菌群失調和BA 的改變是否以及如何調節腸道幹細胞生态位的穩态。
研究亮點

阿司匹林使用者有明顯的腸道微生物群失調,導緻腸道損傷。 被阿司匹林消耗的金氏拟杆菌(P. goldsteinii)能夠減輕阿司匹林相關的腸道屏障破壞。 金氏拟杆菌及其代謝物7-酮-立洛酮酸(7-keto-LCA)維持腸道内穩态。 7-Keto-LCA作爲FXR拮抗劑,能夠促進Wnt信号傳導和幹細胞增殖。
試驗結果
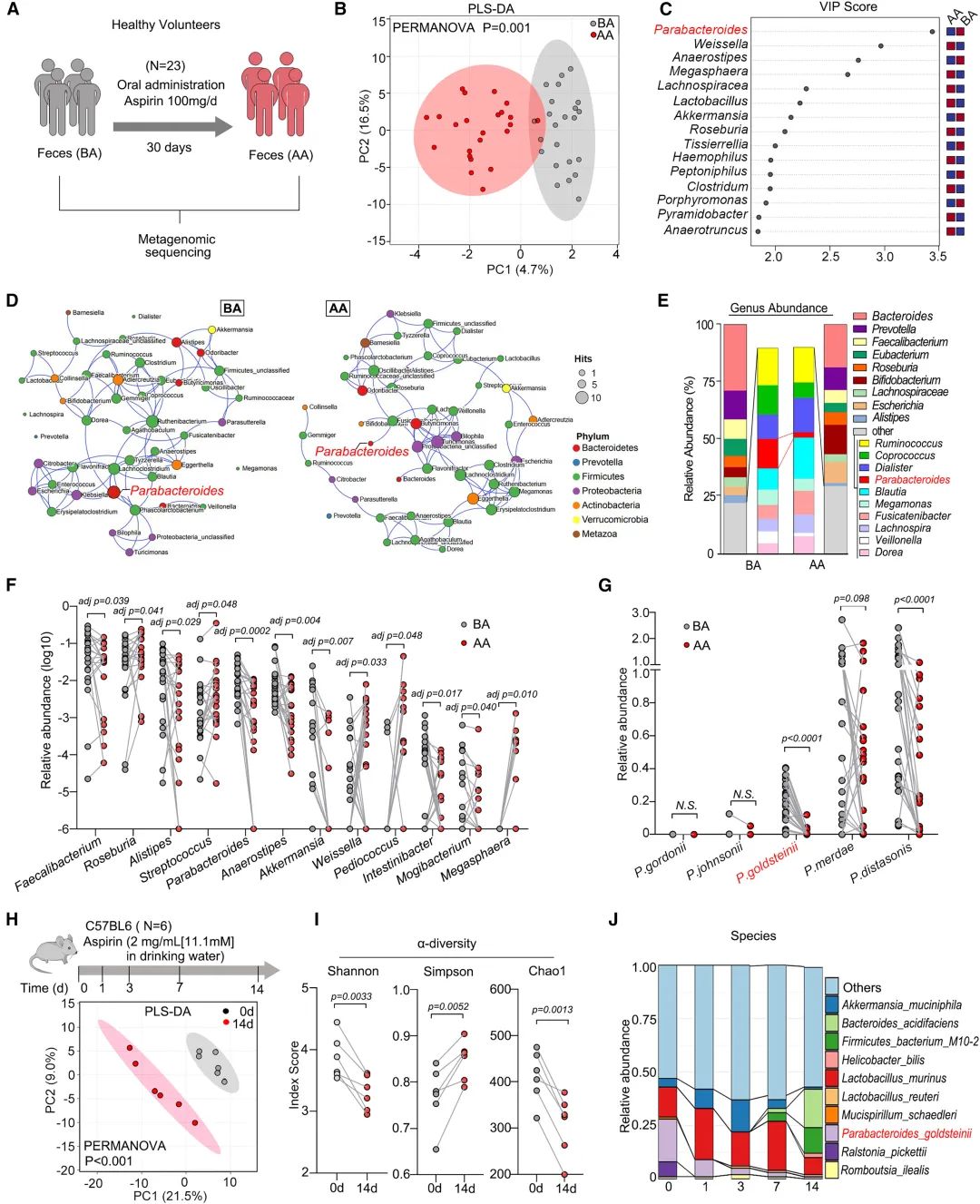 圖1:阿司匹林誘導人和小鼠腸道生态失調
圖1:阿司匹林誘導人和小鼠腸道生态失調

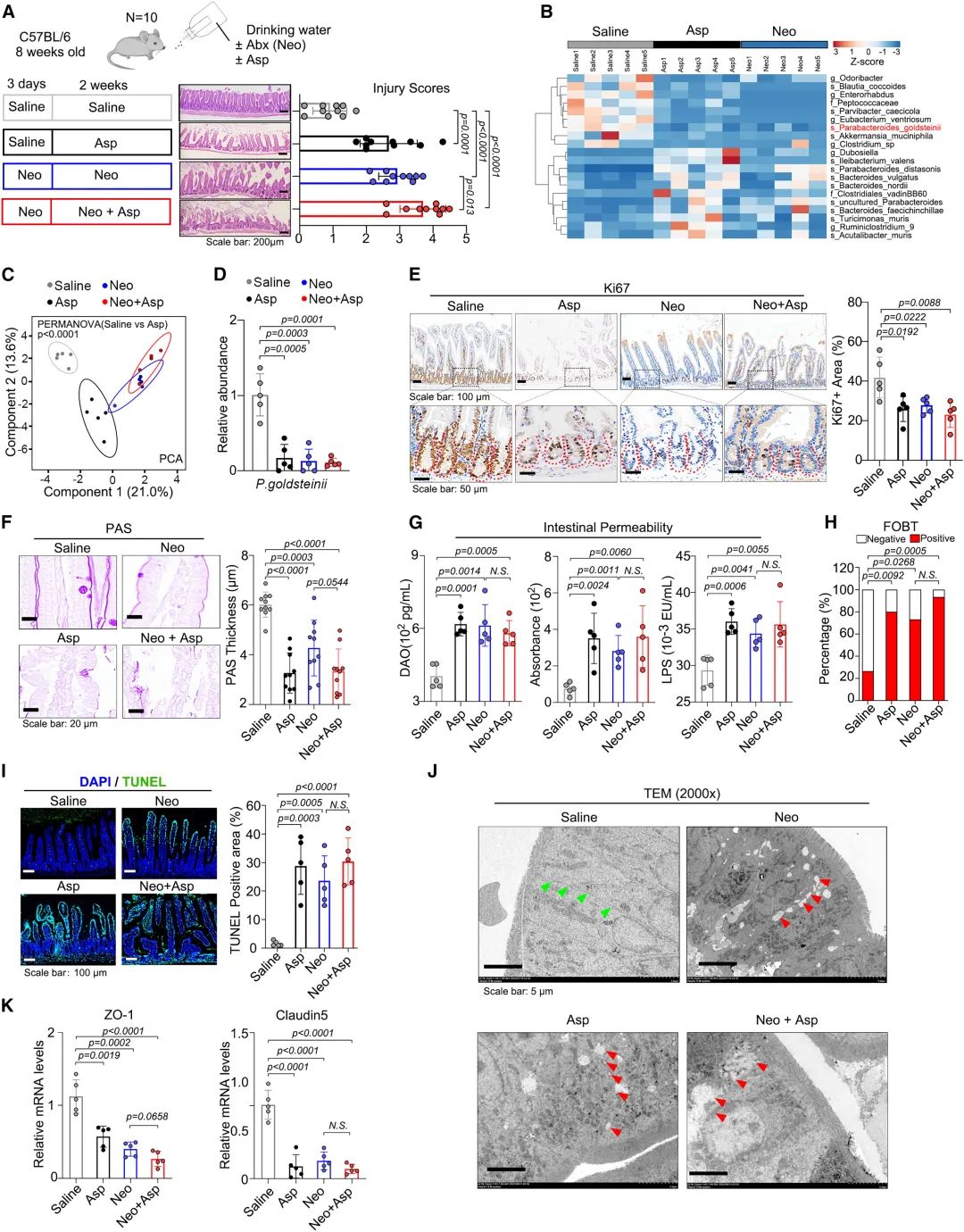
圖2:阿司匹林損害腸道屏障功能,導緻腸道損傷

另外兩種經典抗生素克林黴素和鏈黴素也被用來清除腸道菌群(CS組)。有趣的是,CS組金氏拟杆菌屬的相對豐度沒有變化。此外,保存金氏拟杆菌屬的CS組經阿司匹林治療後的腸道通透性、粘蛋白層厚度、隐窩細胞增殖和凋亡以及FOBT發生率的影響似乎更具抵抗力。這些結果提示,被新黴素根除的金氏拟杆菌屬可能在腸道損傷中起作用。
對無菌(GF)小鼠進行了更進一步的研究,一組GF小鼠直接用阿司匹林治療2周,而一組GF小鼠(RGF組)首先通過與SPF小鼠共居使之自然獲得菌群,然後再進行阿司匹林治療。腸道内容物的16S測序顯示,金氏拟杆菌屬在阿司匹林治療的RGF小鼠中成功定植。研究者發現阿司匹林對GF小鼠沒有明顯的有害作用。然而,服用阿司匹林的RGF小鼠的組織學具有顯著更高的損傷評分和惡化的腸道表型。
這些數據表明,腸道微生物區系的重建可能介導了阿司匹林對腸道的破壞作用。
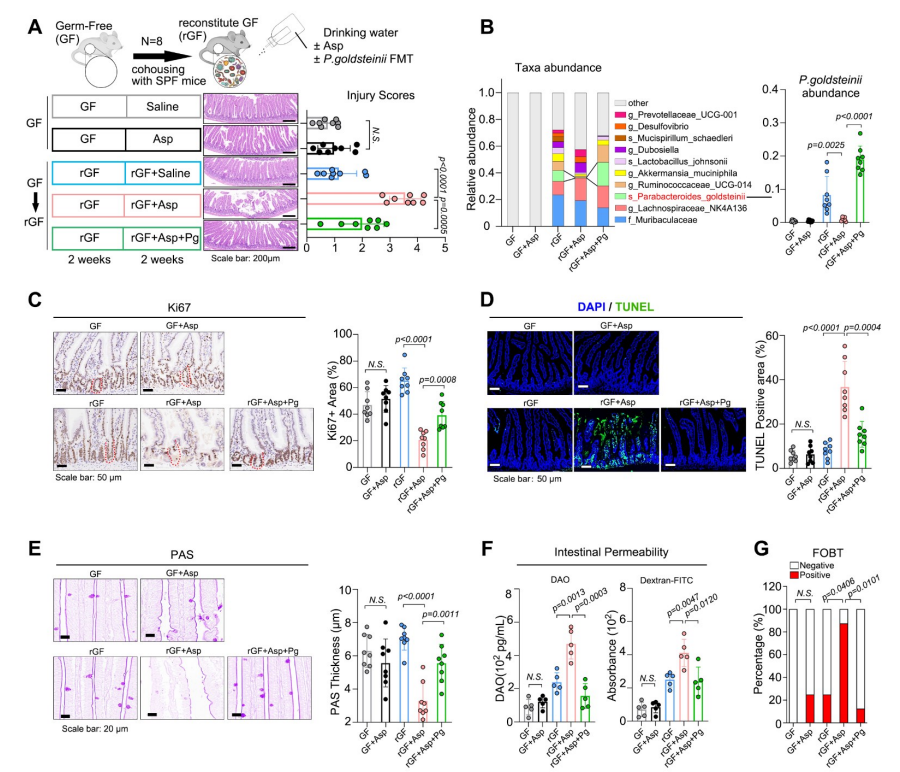

實驗發現,阿司匹林處理後的金氏拟杆菌屬生長受到劑量依賴性的抑制。非靶向代謝組學分析顯示,阿司匹林相關代謝物富含與氨基酸代謝相關的化合物。其中L-谷氨酰胺、檸檬胺和L-脯氨酸被發現是核心成分。補充L-谷氨酰胺和檸檬黃氨酸可以緩解阿司匹林對金氏拟杆菌屬生長的抑制,這表明阿司匹林可能通過幹擾這兩種代謝物的生物合成來影響金氏拟杆菌屬。另外,研究還發現金氏拟杆菌屬對宿主的代謝物有調節作用。阿司匹林治療會顯著降低腸道中某些膽酸的濃度,而金氏拟杆菌屬移植則能保持這些濃度。此外,金氏拟杆菌屬的豐度與膽酸呈正相關。上述結果表明,金氏拟杆菌屬在調節腸道膽酸模式方面具有生物活性作用。研究還發現金氏拟杆菌屬能産生7-酮-立洛酮酸,但不能産生熊去氧膽酸(UDCA),且金氏拟杆菌屬的存在恢複了阿司匹林耗竭後的腸道膽酸譜的平衡。
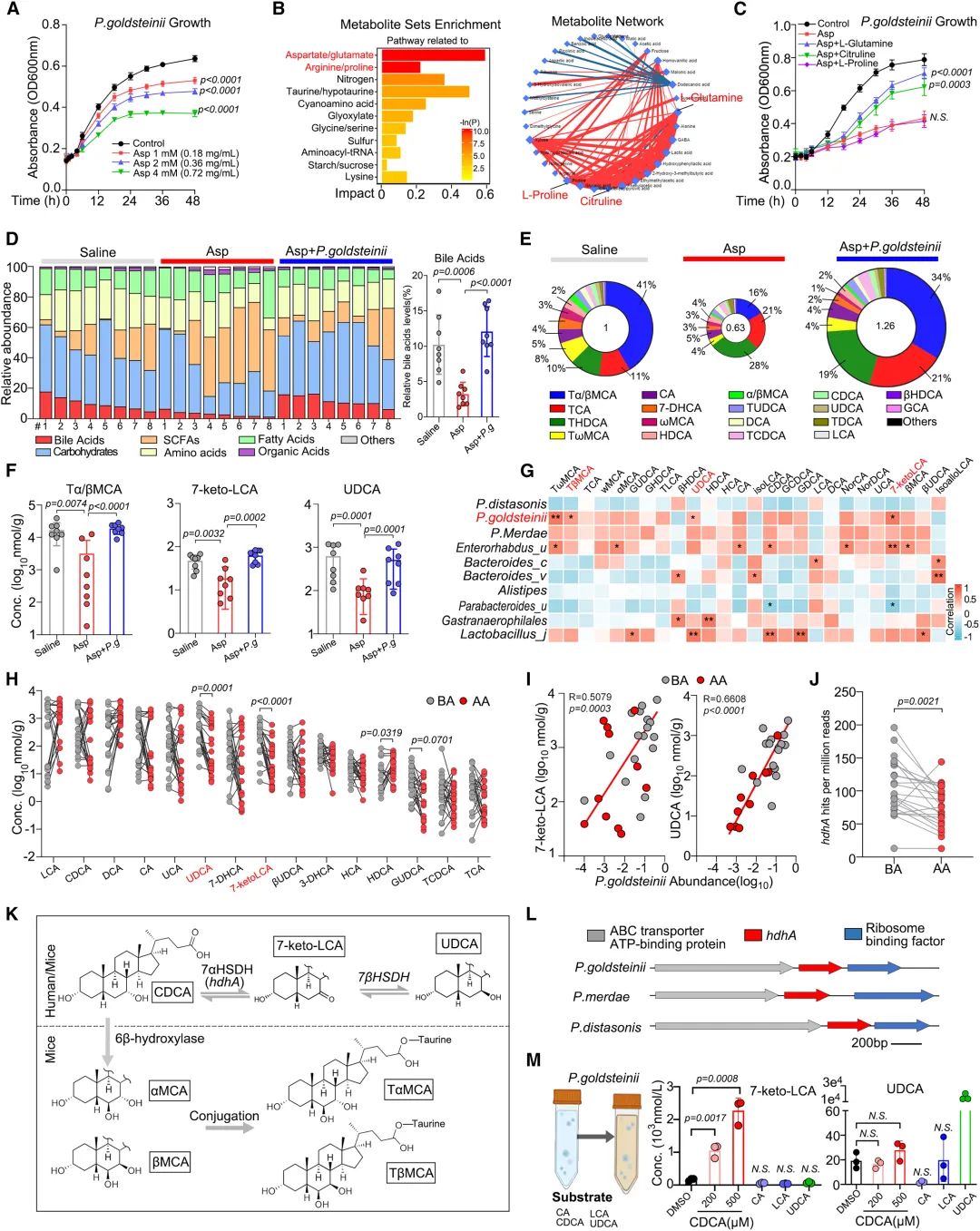
圖4:被阿司匹林耗盡的金氏拟杆菌屬可恢複腸道微生物區系和膽汁酸代謝産物譜

研究發現,金氏拟杆菌屬突變株PGΔhdhA(通過敲除 hdhA 基因構建了缺乏 hdhA 的 P. goldsteinii 突變株)無法将鵝去氧膽酸(CDCA)轉化爲7-酮-立洛酮酸。然而,hdhA對金氏拟杆菌屬的生長沒有影響,且其在宿主體内的定植也沒有受到影響。使用活的金氏拟杆菌屬(LPG)和野生型金氏拟杆菌屬(PGwt)移植可以改善阿司匹林引起的腸道損傷,并恢複腸道通透性,而熱殺死的金氏拟杆菌屬(HPG)或PGΔhdhA則沒有這種效果。進一步的分析顯示,LPG和PGwt能夠逆轉阿司匹林對腸粘液屏障的破壞,并對杯狀細胞有積極作用。此外,LPG的移植可以幫助恢複阿司匹林引起的腸道微生物失調。使用大腸杆菌(E. coli)構建了hdhA的功能增益模型,發現恢複hdhA的菌株(EcD:hdhA)在小鼠腸道中定植,并能降低腸道損傷評分,維持腸道屏障,增加隐窩中增殖細胞數量,并減少凋亡面積和FOBT發生率。此外,實驗結果表明UDCA和7-酮-立洛酮酸都能預防阿司匹林引起的腸上皮損傷,并提高腸道緊密連接的标記物的mRNA水平。綜上,這些研究結果顯示,通過hdhA基因産生的膽汁酸可以預防阿司匹林引起的腸道損傷。
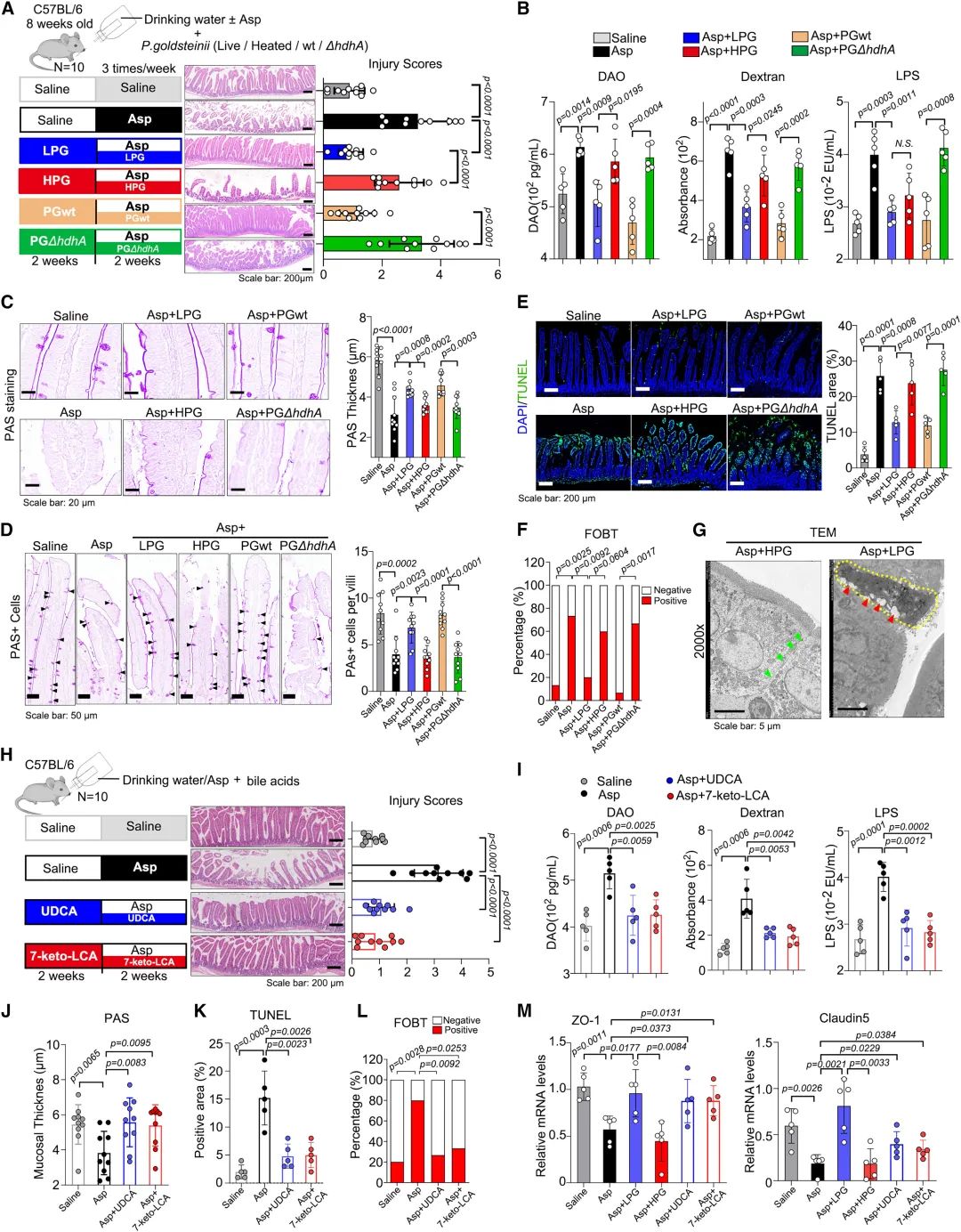
圖5:金氏拟杆菌屬通過hdhA基因改善阿司匹林誘導的腸道損傷

FXR 是一種BA受體,在腸道幹細胞擴增和腸道屏障中起着關鍵作用。此前,研究發現調節FXR的活性可促進腸道細胞向腸樣表型轉分化。因此,研究使用了一種腸特異性FXR基因敲除的小鼠模型。Fxr-floxed 小鼠(Fxrfl/fl)和腸特異性 Fxr-null 小鼠(FxrΔIE)經阿司匹林治療後,腸道屏障破壞、生長抑制、細胞凋亡、粘膜厚度、杯狀細胞減少和 FOBT 率均有所減輕。更有趣的是,阿司匹林治療後,核分布β-catenin和Olfm4的隐窩細胞數量減少,而通過敲除腸道FXR可減輕這一現象。此外,敲除FXR 後,杯狀細胞和潘氏細胞的數量都增加了。爲了确定抑制金氏拟杆菌的原因是阿司匹林還是随後的腸道損傷,對腸内容物進行了 16S 測序分析。阿司匹林改變了 Fxrfl/fl 和 FxrΔIE 小鼠微生物群的主要組成。在這些小鼠中,金氏拟杆菌的相對豐度都降低了,這表明阿司匹林直接誘導了金氏拟杆菌的抑制,而不是腸道損傷的結果。這些數據共同表明,FXR 部分介導了阿司匹林對腸道的影響。
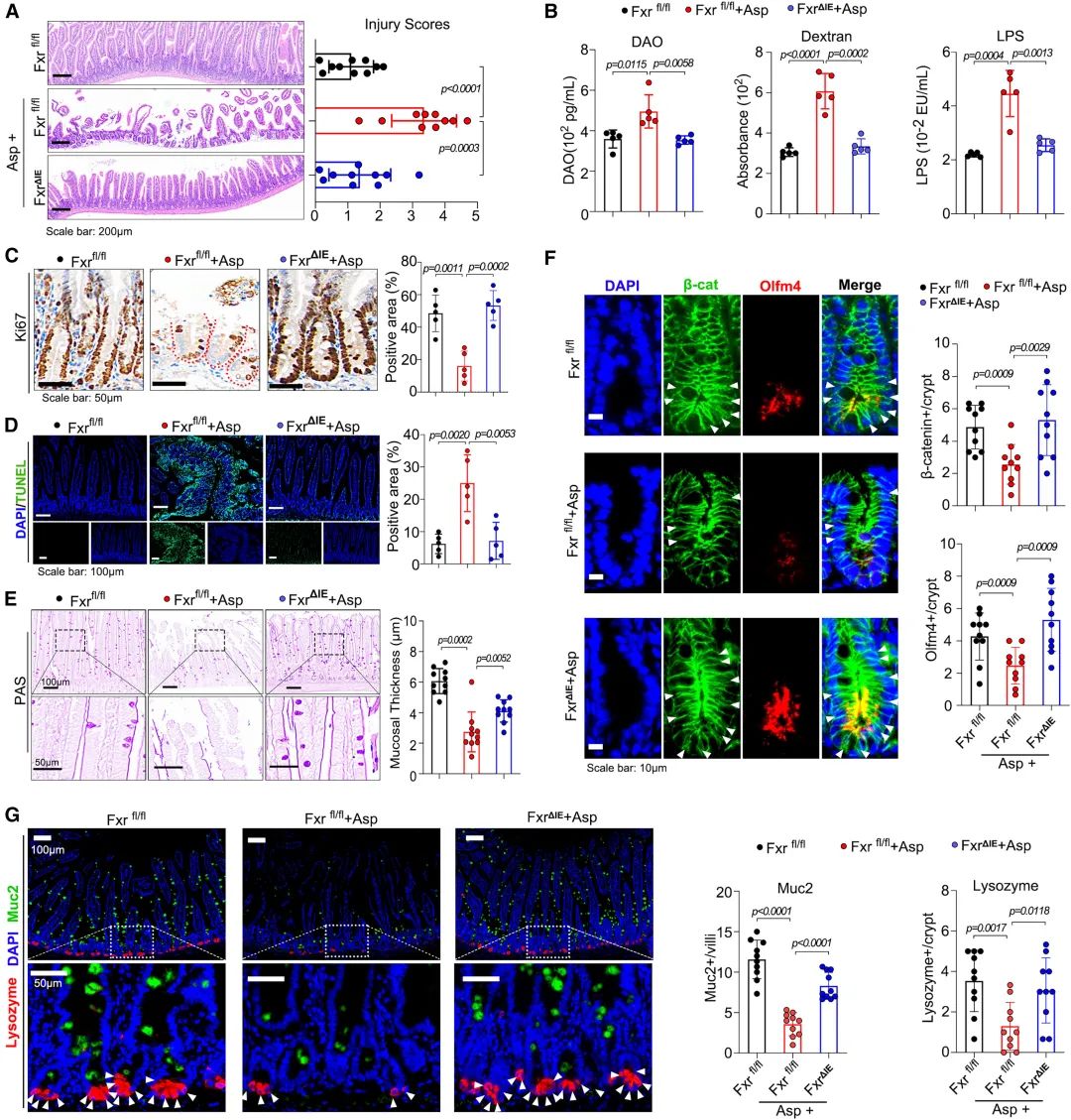
圖6:FXR腸道特異性敲除可減輕阿司匹林誘導的腸道損傷

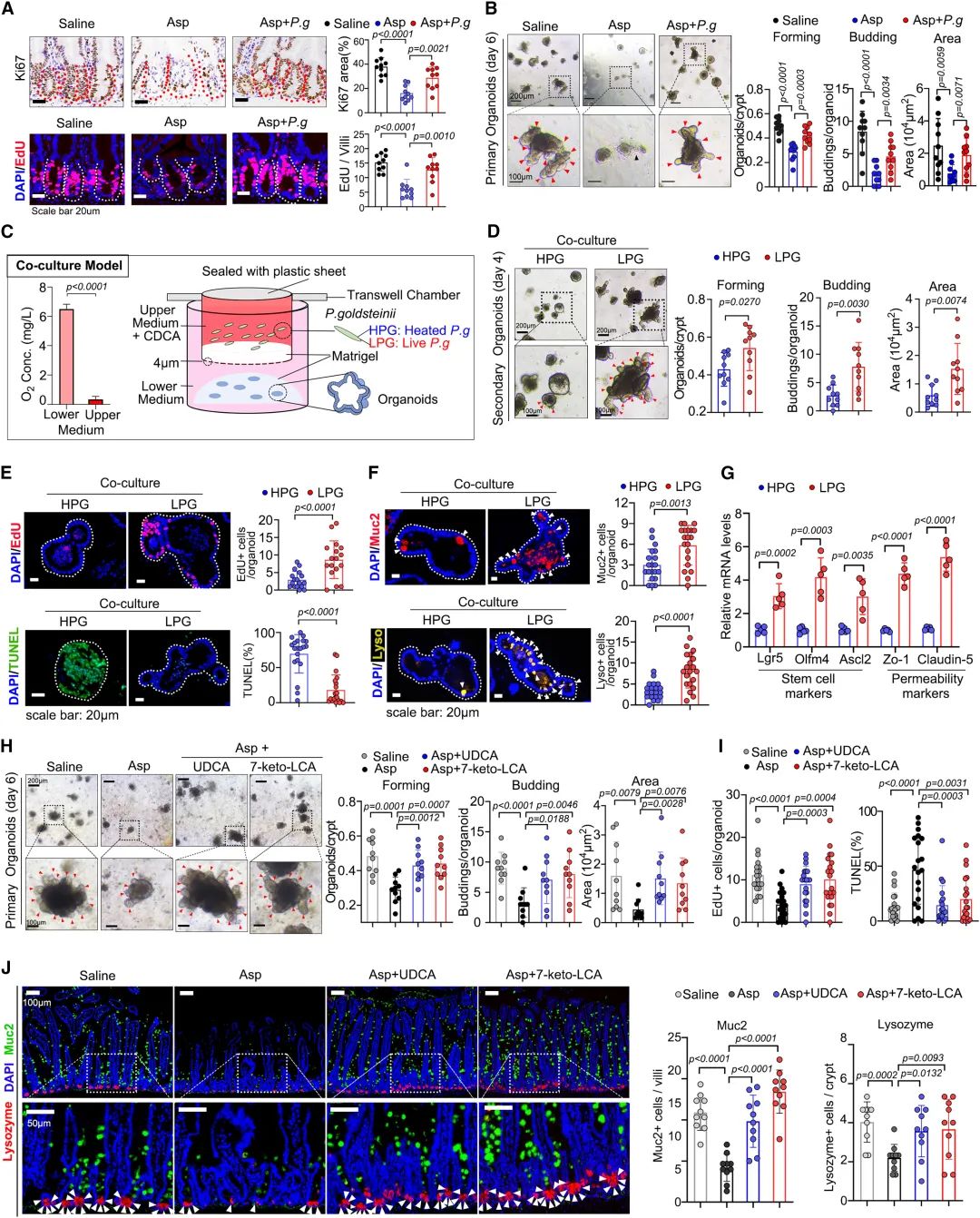
圖7:金氏拟杆菌通過調節膽汁酸代謝促進腸道自我更新
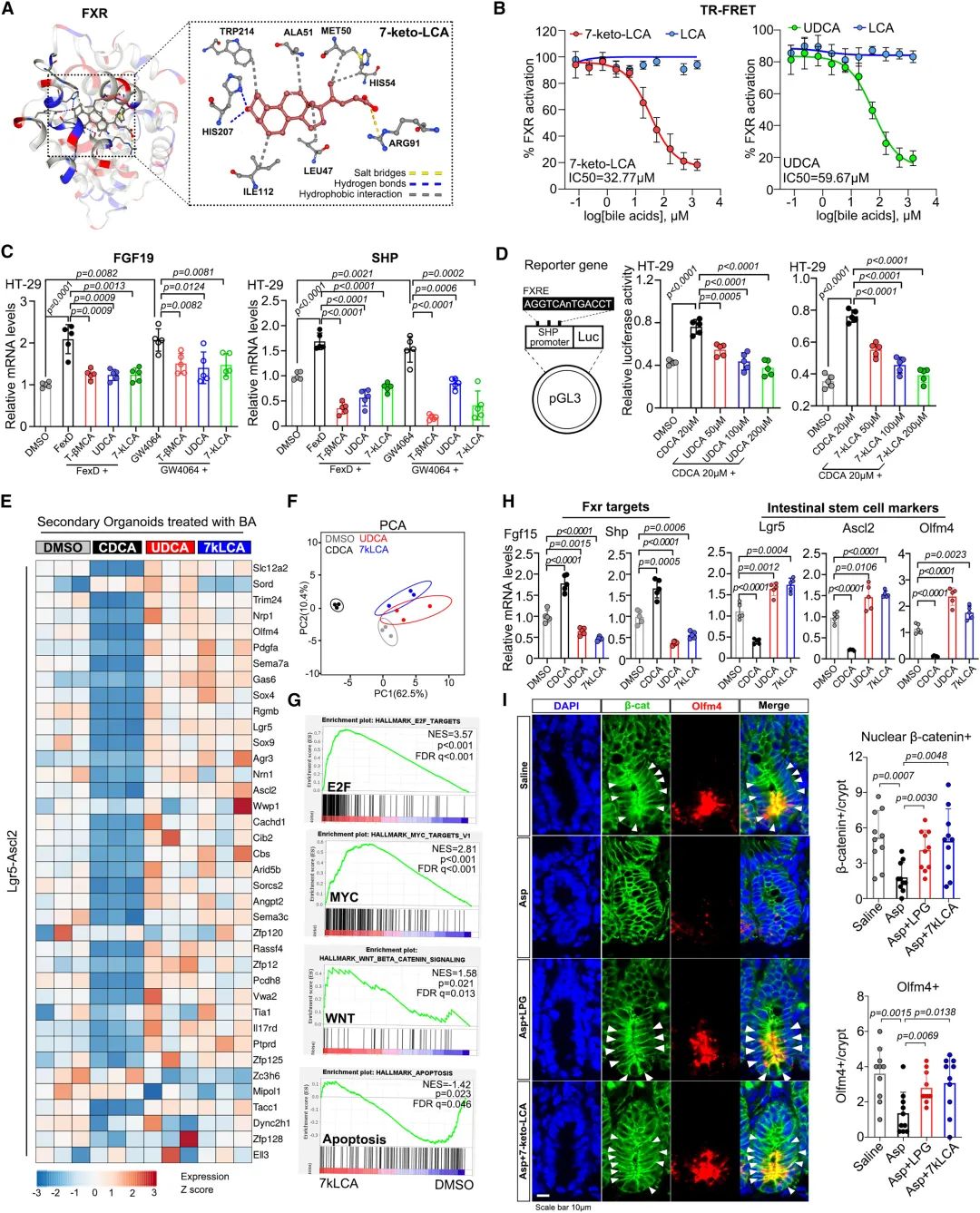
圖8:7-酮-立洛酮酸是一種FXR拮抗劑,促進Wnt信号傳導
總結

版權聲明:本公衆号中使用的圖片及相關資料來源于上述學術論文及其補充材料或實驗室官方發布的任何信息,标注“原創”僅代表原創編譯,本公衆号不主張對原文的版權,版權歸原作者及出版社所有。如作者或版權所屬機構不希望被轉載或認爲有侵權行爲,請聯系本平台删除。本平台的分享僅出于學術交流和傳播信息需要,并不意味着相關内容代表本平台觀點或已證實其内容的真實性。本平台尊重所有版權協議及相關法律法規。點擊下方閱讀原文,可直達原文鏈接!

關于腸道微生态康複
"君易置"生物科技是一家集醫學研究、試驗發展、技術服務于一體,專注于人體腸道微生态重建和腸道微生态個性化健康管理的高新技術企業。到目前爲止,君易置已經與二十餘家三級醫院,共同合作開展基于菌群移植幹預的臨床和基礎研究,已累計開展研究項目三十餘項,部分項目已參與申報國家自然基金及各類基金。