【摘要】目的 :代謝相關脂肪肝( MAFLD )的發病機制複雜。脂質代謝紊亂、慢性炎症和氧化應激是 MAFLD 的核心事件。飲食幹預是預防 MAFLD 發病和進展的重要治療策略。丁酸梭菌( CB )和可溶性膳食纖維( SDF )通常被認爲對健康有益。我們探讨了兩種針對微生物群的幹預措施( SDF 和 CB )如何影響 MAFLD 小鼠的肝髒免疫系統、氧化應激和脂質代謝。方法:通過給 C57BL/6 小鼠喂食高脂飲食( HFD ),建立 MAFLD 小鼠模型,探讨SDF 和 CB 在 MAFLD 中的作用。幹預 8 周後,我們測量了小鼠肝髒的免疫細胞功能、脂質代謝和氧化應激水平。結果:單次 SDF 或 CB 幹預對改善 MAFLD 無效;然而,與 SDF 和 CB 的聯合幹預增加了微生物多樣性,減少了炎症、氧化應激和脂質合成。此外,我們确定,通過激活 Acly/Nrf2/NF-κ B 信号通路,與 SDF 和 CB 共同幹預介導的脂肪酸氧化。最重要的是,聯合幹預通過抑制巨噬細胞分化爲促炎性 M1 巨噬細胞發揮抗炎作用。結論:本研究表明, SDF 和 CB 的聯合幹預可以改善 MAFLD , SDF 和 CB 的聯合幹預可能是 MAFLD 潛在的腸道微生物群調節劑和治療物質。
【介紹】
過去20年的大量研究清楚地表明,非酒精性脂肪肝(N A FLD )是一種代謝性疾病。與全身代謝功能障礙相關的脂肪肝很常見,影響全球約24%的成年人。在這種高發病率的背景下,專家們達成了共識,即非酒精性脂肪肝并不反映當前的知識,以及代謝相關疾病的新概念脂肪性肝病“MAFLD ”的提出是爲了克服MAFLD定義的局限性。 MAFLD 代表從單純性脂肪變性到非酒精性脂肪性肝炎(NASH )的一系列疾病狀态,包括纖維化、肝硬化和肝細胞癌。随着飲食和生活方式的改變,MAFLD 已發展成爲一個全球健康問題。然而,MAFLD 的發病機制尚不清楚。它是一種複雜的多因素疾病,涉及脂質代謝、線粒體功能障礙、腸道菌群紊亂、巨噬細胞編程和表觀遺傳改變,這些改變了肝髒微環境,會傾向于肝髒損傷。因此,MAFLD的特點是慢性炎症、簡單脂肪變性和低水平的氧化應激反應。肝脂肪變性、炎症、内毒素和氧化應激之間的相互作用已得到充分描述。大量肝髒脂肪堆積導緻促炎因子(TNF-α、IL-6和IL-1β)釋放,并導緻促炎環境。此外,巨噬細胞是肝髒炎症的關鍵影響細胞。肝髒中M1和M2巨噬細胞的極化是炎症反應、肝細胞損傷和活化的重要步驟-肝衛星細胞的分化。在M AFLD 患者中,常伴有腸道微生物群失調和腸道粘膜屏障功能受損,使脂多糖(LPS)易于通過門靜脈到達肝髒。值得注意的是,M1巨噬細胞被LPS、TNF-α和IFN -γ激活。M1巨噬細胞主要參與核因子κB(NF-κB)激活,并産生大量活性氧(ROS)以促進氧化應激。在肝髒中,氧化應激和炎症導緻肝髒脂肪變性。綜上所述,随着MAFLD 的進展,炎症、氧化應激、内毒素和脂質沉積相互促進,形成正反饋回路。因此,改善肝髒脂肪變性、氧化應激和肝髒炎症是治療MAFLD的一種有前途的策略。目前,除了改變生活方式,包括飲食和鍛煉外,沒有批準的MAFLD 藥物治療。可溶性膳食纖維(SD F)和益生菌是通過調節腸道微生物群來調節脂質代謝和炎症的相對簡單的方法。丁酸梭菌(CB)通過保護腸道粘膜屏障完整性和減少炎症因子改善結腸炎。SDF促進脂質代謝,并降低體重和血糖水平。此外,SDF的CB發酵會産生短鏈脂肪酸(丁酸、丙酸和醋酸鹽),這是腸道内穩态的重要決定因素,與宿主脂質代謝密切相關。然而,CB和SDF在MAFLD 中肝髒脂肪變性、氧化應激和肝髒炎症相互作用中的作用尚不清楚。
【材料和方法】
2.1 動物實驗
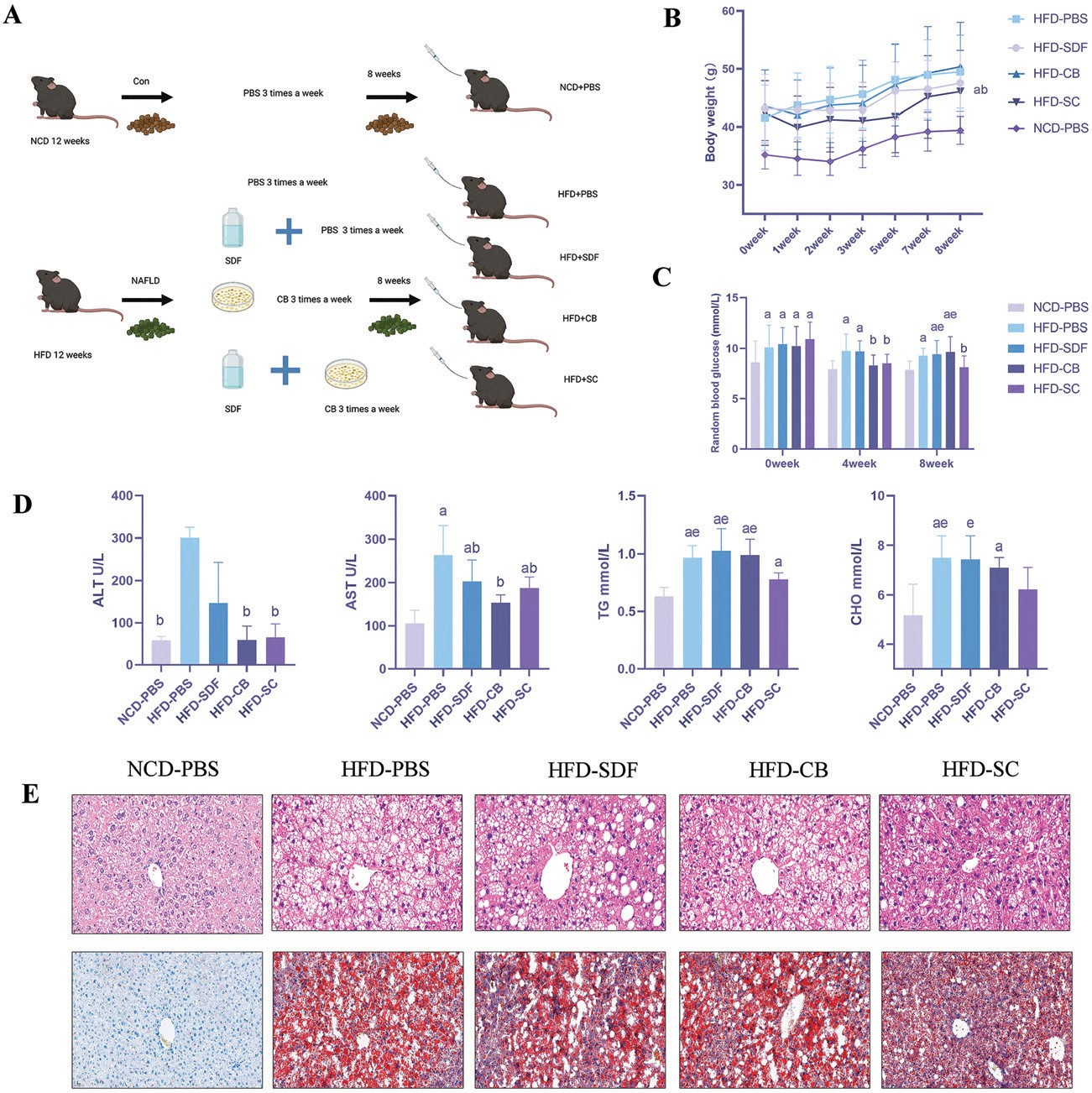
所有實驗程序均按照國立衛生研究院指南進行,并經浙江大 學 動 物 倫 理 委 員 會 批 準 。 雄 性 C57BL/6小 鼠(18-20g),約6-8周大,購自中國上海斯萊克公司。給小鼠喂食正常的周飲食([NCD ],1025,脂肪含量4%卡路裏;HFKbio,中國)或高脂肪飲食([HFD ],D 12492,脂肪含量60%卡路裏;研究飲食,中國)24周。有三個不同的治療組:SDF組(HFD -SD F)、CB組(HFD -CB)和SDF和CB同時幹預組(HFD -SC)。對于治療組,CB(劑量爲2×109 CFU /0.2 m L)26與H FD 喂養同時給予,每周3次,持續8周(H FD 喂養24周後)。HFD -SD F組和HFD -SC 組接受含有SDF(7g/L)的飲用水 ),同時,NCD -PBS組和HFD -PBS組每周3次灌胃0.6 m L無菌PBS,持續8周(圖1A )。SDF(7克升-1)購自北京同澤康成醫療科技有限公司(成分:低聚半乳糖、水蘇糖、甘露糖寡糖)。27CB(ATCC19398)購自中國微生物總培養收集中心。
2.2 細胞和酪酸梭菌的培養
L02細胞在含有10%胎牛血清(Therm o Fisher Scientific,Inc.)和1%抗生素-抗真菌劑的DMEM (Therm o FisherScientific,Inc.)中培養。将約5×105個細胞接種到12孔闆中(每組3孔)。用15μg m L處理L02細胞1棕榈酸(PA)48小時,作爲MAFLD 模型細胞。在這48小時内,幹預組接受不同濃度的丁酸(200、400和600μM )治療。CB在37°C的厭氧條件下在腦心輸液培養基中培養24小時,直到在A600的細菌密度爲0.5的對數生長期。通過離心(3000g×5分鍾)收集細菌,并在無菌磷酸鹽緩沖液(PBS)中重新懸浮至最終實驗濃度2×109 CFU /0.2 m L,該濃度是根據之前的研究和初步實驗選擇的。26收集上清液,通過0.22μm 孔徑的過濾器過濾,然後用完整的培養基稀釋。
2.3 組織學分析
将肝組織在多聚甲醛(4%)中固定24小時,并将其包埋在PA RAffin中。對于蘇木精和曙紅(h&E)和M asson三色染色,将PARA ffin包埋的樣品分别切片爲5µm 和3µm 厚。使用Masson的三色染色試劑盒(Solarbio,G 1340,中國)進行Masson三色染色。使用蘇木精-伊紅/HE染色試劑盒(Solarbio,G1120,中國)進行H&E染色。然後使用點滑掃描系統(英國海上索森德奧林巴斯)觀察組織切片。
2.4 蛋白質印迹分析
使用添加蛋白酶抑制劑和蛋白酶抑制劑的RIPA buffer提取組織和細胞蛋白質。用适當的抗核因子紅系-2相關因子2(Nrf2)(12721,細胞信号;稀釋度:1:1000)、Keap1(98047,細胞信号;稀釋度:1:1000)、HO-1(822069,細胞信号 ;稀釋度1:1000)、 toll樣 受 體 4(TLR4)(14358,細胞信号;稀釋度:1:1000)、半胱天冬酶-1(Ab179515,Abcam ;稀釋度:1:1000)的一級抗體孵育細胞膜,IL-1β(#27989,細胞信号;稀釋度:1:1000)和脂肪酸和脂質代謝抗體(#8335,細胞信号;稀釋度:1:1000)。β-肌動蛋白(#AF0003,Beyotim e;稀釋度:1:1000)和GAPDH (#1E6D 9,Proteintech;稀釋度:1:1000)用作蛋白質的内部對照。使用Im ageJ軟件通過密度測定法對蛋白質進行定量。
2.5 序列分析
16S rRNA基因測序由諾沃金生物信息技術有限公司(中國北京)進行。使用天根試劑盒從冷凍糞便樣本中分離細菌DNA 。通過PCR擴增16S rRNA基因的V3–V4高變區。測序在IlluminaHiseq平台上進行(Illum ina,聖地亞哥,加利福尼亞州,美國)。這個
QIIME平台用于将讀取數據聚類到操作分類單元(OTU )、質量控制和微生物數據分析中。轉錄組測序由諾沃金生物信息技術有限公司(中國北京)進行。測序庫是使用NEBN ext®Ultra構建的™ 按照制造商的說明,定向RNA庫制備試劑盒(美國NEB)。GO seqR包用于差異表達基因的GO富集分析。KEGG被用來從分子水平上理解生物系統的功能。
2.6 流式細胞術
将各組的肝組織均質,制備單細胞懸液。用以下抗小鼠抗體 對單個肝細胞進行染色:抗CD45-FITC (克隆30-F11; BioLeg end,美國 )、 抗CD11b-APC(克隆M1/70,BioLeg end)、抗F480 -BV421(克隆BM8;BioLegend,美國)、抗CD206-PE(克隆C068C2;BioLegend,美國)和抗MHCII-PECy7(克隆M5/114;BioLegend,美國)。使用 FV S78 0(BD Biosciences,U SA )測定巨噬細胞的數量。使 用BD 進行流式細胞術™ LSRFortessa公司 (BD Biosciences)。使用FlowJo軟件v10.0(BDBiosciences)進行分析。根據制造商的說明,使用帶有V-底闆V02(目錄号740379;BioLeg end,美國)的小鼠面闆 (5-Plex)對血漿細胞因子進行定量。分析的細胞因子包括:IFN-γ、TNF-α、IL-6、IL-10和IL-1β。
2.7 酶聯免疫吸附試驗(ELISA)
稱重肝組織(30mg)并在PBS中均質,以制備10%的勻漿。使用ELISA試劑盒(L21123317,Uscnk,中國武漢)測定肝勻漿中的LPS水平。将标準品和樣品在室溫下鍍在預先塗有LPS特異性抗體的微孔闆上2小時。孵育後,清洗樣品,然後用HRP結合的抗小鼠IgG(1:1000)孵育。洗滌後,在450nm處讀取标準品和樣品。數值以pg-ml表示1.
2.8 統計分析
使用SPSS 21.0進行統計分析。測量數據以平均值±标準差表示。使用雙向ana分析各組間的比較-方差分析(ANOVA)和最小顯著差異(LSD)。所有P值均爲雙尾,P值<0.05的差異具有統計學意義。
【後果】
3.1 SDF和CB的聯合幹預改善了HFD誘導的MAFLD
實驗期間的重量變化如圖1B所示。飲食幹預前,HFD喂養的小鼠體重顯著高于NCD喂養的小鼠,表明成功建立了MAFLD模型。幹預8周後,HFD-SC組的體重顯著低于HFD-PBS組(p<0.05)。然而,在H FD -PBS小鼠和兩個 單一幹預組之間未觀察到體重的顯著變化。此外,我們在第一個月沒有檢測到四個HFD喂養組(HFD-PBS、HFD-CB、HFD-SDF和HFD-SC)之間的随機血糖差異(圖1C )。與HFD-PBS組相比,HFD-SC 組在第4周和第8周的随機血糖水平顯著降低(p<0.05)。值得注意的是,HFD-CB組在第4周的血糖水平低于HFD-PBS組,但這一現象在第8周消失。我們認爲這與長期接觸HFD有關。與HFD-PBS組相比,HFD-SC組的肝丙氨酸轉氨酶(ALT)、天冬氨酸轉氨酶(ASPA)顯著降低-胃酸轉氨酶(AST)、甘油三酯(TG)和膽固醇(CHO)水平(p<0.05;圖1D)。肝切片用H&E和油紅O染色,以證明不同處理對MAFLD進展的影響(圖1E)。H&E和油紅0染色結果顯示,NCD喂養小鼠的肝組織完整,細胞清晰可見,肝小葉結構完整,沒有脂質積聚。相反,HFD喂養的小鼠表現出松散和伸展的肝細胞、肝細胞氣球樣變、小葉炎症和小葉脂質填充的細胞内空泡。此外,在四組HFD喂養的小鼠中,與HFD-PBS組相比,HFD-SC組觀察到的上述病理變化有所改善。生化檢查和肝組織病理學數據顯示,SDF和CB聯合幹預可顯著減輕HFD-PBS小鼠的肝脂肪變性。
3.2 SDF和CB聯合幹預改善HFD 誘導的炎症
慢性炎症是MAFLD的一個重要特征。值得注意的是,MAFLD的特征是肝髒中單核細胞源性巨噬細胞(MOMF)的增加。MOMF和Kupffer細胞(KC)分泌一系列促炎細胞因子,引起肝髒和全身炎症。因此,我們檢測了肝髒MOMF和血清炎症因子水平(TNF-α、IFN-γ、IL-1β、IL-10和IL-6)。與對照組相比,HFD -PBS組的肝髒KC百分比增加(圖2A和圖2)
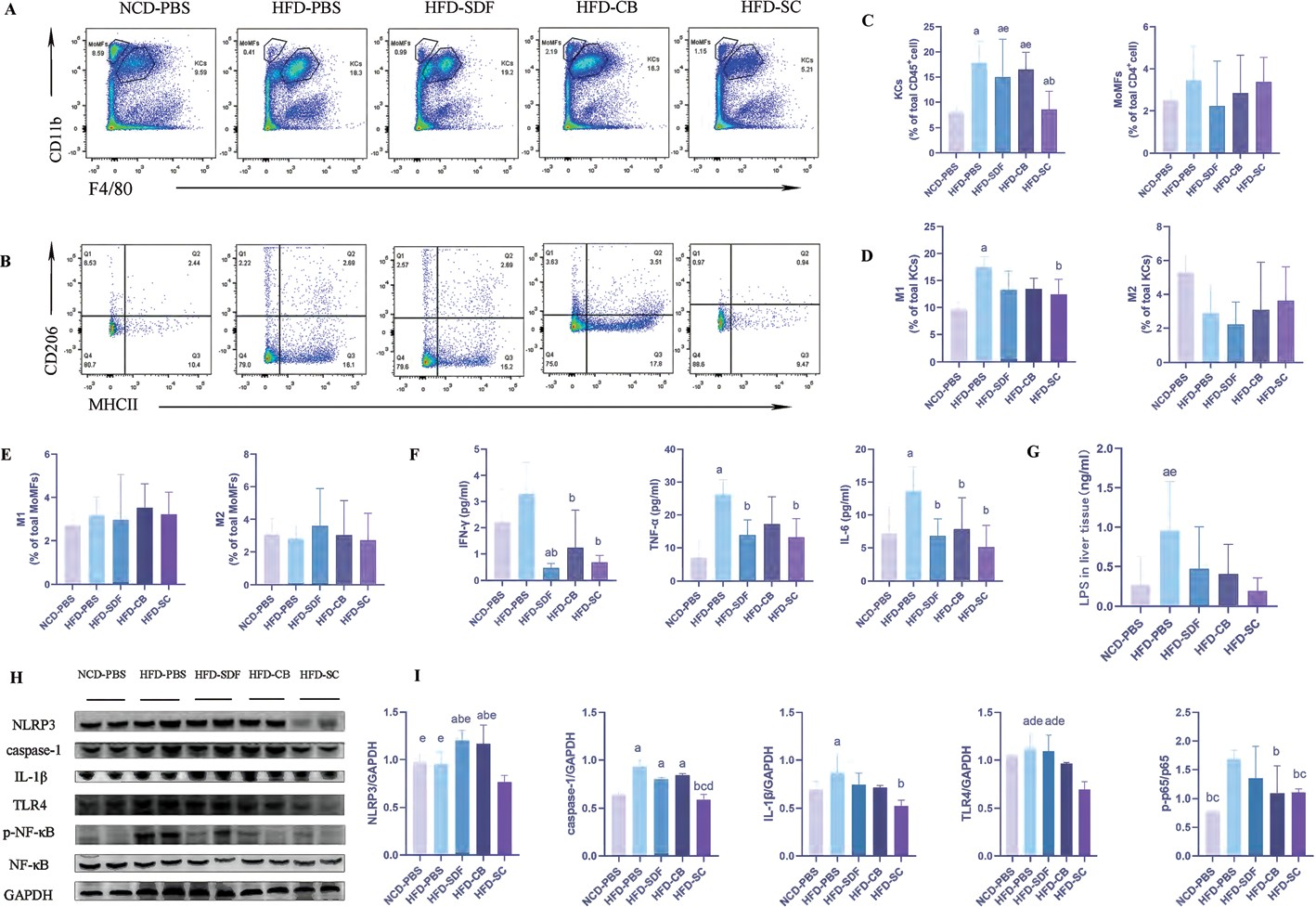
圖2 SDF 和 CB 聯合幹預抑制 HFD 誘導的炎症。( A )肝内巨噬細胞( KC 和 MOMF )的代表性流式細胞術圖。( B )KC中M1/M2巨噬細胞的代表性流式細胞術圖。( C )肝CD45+細胞中巨噬細胞的百分比。( D ) KC中M1/M2巨噬細胞的極化。( E )MOMF 中 M1/M2 巨噬細胞的極化。( F )血清炎症因子水平。( G )肝髒中NLRP3和p-P65的代表性免疫印迹分析。( H )NLRP3和p-P65豐度的定量分析。數據以平均值±标準差表示,每組n=4–7 。a:p<0.05 ;與 NCD-PBS 相比, b:p<0.05 ;與 HFD-PBS 相比;c:p<0.05 ;與HFD-CB相比;d:p<0.05 ;與HFD-SDF相比;e:p<0.05;與HFD-SC相比。KC極化爲M1促炎表型(圖2B和D )。此外,與SDF和CB的聯合幹預顯著降低了肝髒KC的百分比,并抑制了M 1巨噬細胞的激活。然而,單用SD F或CB幹預對MOMF和M1巨噬細胞沒有類似的影響。M 2巨噬細胞的百分比在各組之間沒有差異(圖2E)。同時,H FD -PBS組的血清TN F-α、IFN -γ和IL-6水平也升高。與上述結果一緻,H FD -SC組中上述三種炎性細胞因子的水平低于HFD-PBS組(圖2F)。然而,各組中IL-1β和IL-10的濃度過低,無法檢測到。上述結果表明,與SD F和CB的聯合幹預通過介導KC分化改善了M AFLD 小鼠的炎症反應。膳食飽和脂肪酸誘導的NF-κB激活和核移位導緻産生促炎 症細胞因子 (IL-6、 TN F-α和 IL-1β)。31,32N F-κB信号通路也通過介導M1巨噬細胞的激活而成爲MAFLD的主要貢獻者。此外,LPS刺激M1巨噬細胞激活NF-κB,從而誘導NOD 樣受體家族3(N LRP3)的表達。考慮炎症和MAFLD之間的關系,以及NF-κB對MAFLD的調節作用M1巨噬細胞激活,進行western印迹以确定N LRP3炎症體(NLRP3、IL-1β和caspase-1)和TLR4/NF-κB信号通路的激活(圖2H 和I)。此外,我們還檢測了肝組織勻漿中LPS的水平。正如預期的那樣,HFD治療顯著增加了LPS的水平,并通過TLR4誘導NF-κB的磷酸化。此外,與SDF和CB聯合幹預可有效降低LPS水平 (圖2G ),并抑制TLR4/N F-κB信号通路的激活。一直以來,與SD F和CB的聯合幹預對N LRP3炎症體的激活産生了類似的影響。
3.3 在HFD 誘導的MAFLD 中,SDF和CB改變了基因轉錄
爲了确定SDF和CB聯合幹預如何改善MAFLD,使用轉錄組測序分析對不同組的肝組織轉錄組進行測序。各組之間的基因表達差異如圖3A所示。分别分析了不同組中上調和下調的基因。基于層次聚類分析,NCD-PBS、HFD-PBS和HFD-SC組分别顯示出顯著的聚類趨勢(圖3B),而HFD-CB和HFD-SDF組沒有顯示出顯著的聚類。差異基因通過GO 富集和KEG G 途徑分析進行處理。圖中顯示了KEGG富集程度最高的前20項。與HFD-PBS組相比,KEGG富集分析表明,在H FD -CB組中,主要富集物爲“緊密連接”(圖3C)。此外,在HFD-SDF組中,GO主要富集物爲“脂質生物合成過程”、“類固醇生物合成/代謝過程”和“乙酰輔酶A/acly輔酶A代謝過程”(圖3D )。GO分析表明,這些基因主要富集于抗氧化應激途徑(“NADH脫氫酶(醌/泛醌)活性”、“氧化還原酶複合物/活性”、“過氧化物酶活性”,以及HFD-PBS和HFD-SC組之間的“抗氧化活性”)和線粒體功能(“ATP合成/代謝過程”、“線粒體呼吸鏈”、“線粒體内膜”和“線粒體蛋白質複合體”)(圖3E)。KEGG途徑的主要富集物是H FD -PBS組和H FD -SC組之間的“谷胱甘肽代謝”、“脂肪酸降解”、“MAFLD”和與抗氧化障礙相關的疾病(“阿爾茨海默病”和“帕金森病”)以及“M AFLD ”(圖3F)。因此,我們推測SDF和/或C B通過調節腸道微生物群結構影響腸道緊密連接、脂質代謝和抗氧化應激功能。
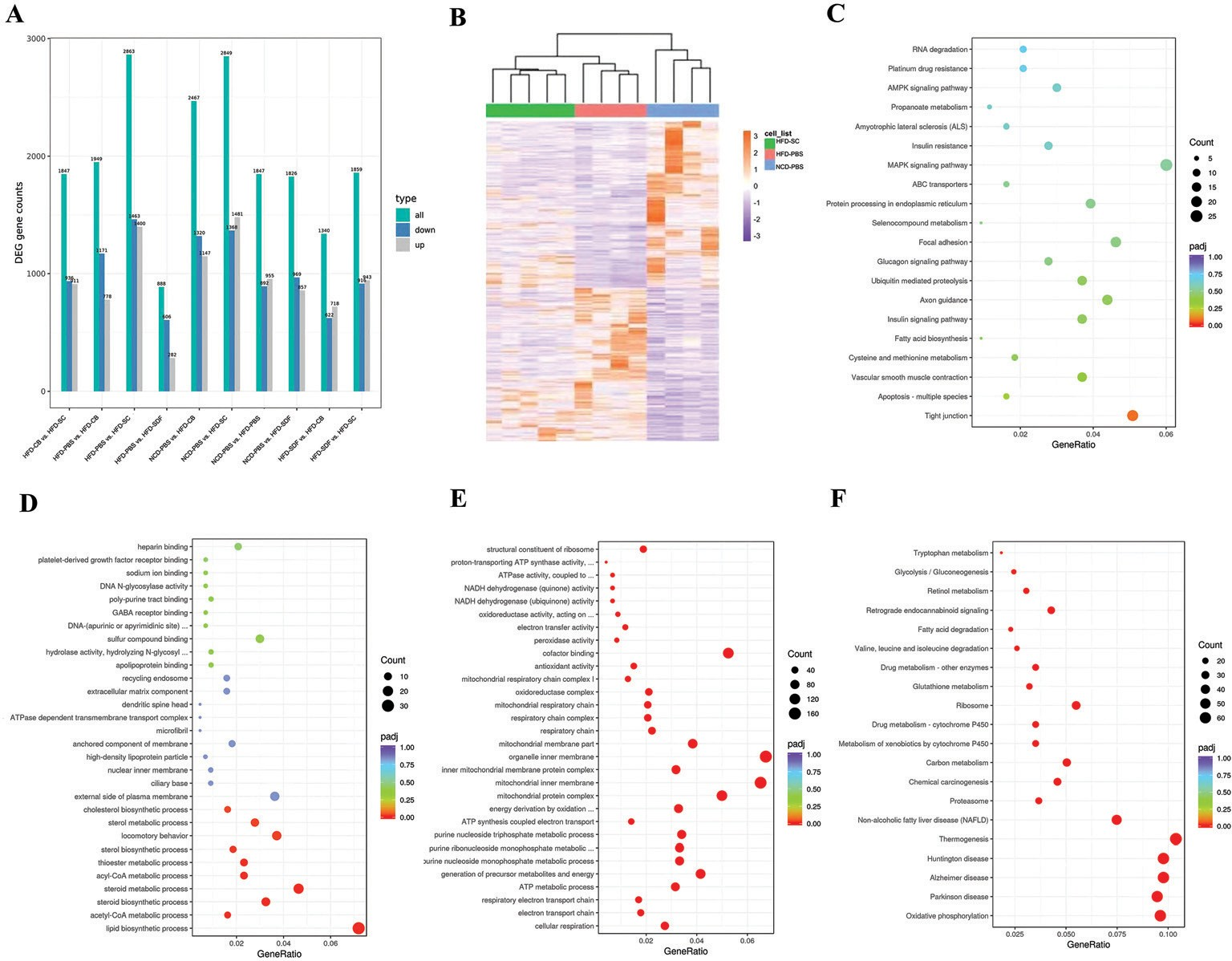
圖3 SDF和CB對肝髒基因轉錄的影響。( A )不同組合中差異表達基因的數量。( B )差異表達基因的聚類熱圖。( C ) HFD-PBS組和HFD-CB組之間的富集KEGG項散點圖。( D ) HFD-PBS組和HFD-SDF組之間的富集GO項散點圖。( E ) HFD-PBS組和HFD-SC組之間的富集GO項散點圖。( F )HFD-PBS組和HFD-SC組之間的富集KEGG項散點圖。 n=4-5/組。
3.4 SDF和CB聯合幹預改善HFD誘導的腸道微生物群失調
爲了确定改變腸道微生物群的組成和結構是否可以改善脂質代謝,先天免疫系統、氧化應激和腸道粘膜屏障的組成,以及爲了探索幹預是否在腸道微生物群或其生物學方面産生了特征性變化,在不同幹預組中評估了微生物群組成、多樣性和功能的變化。通過Simpson、Shannon和C hao1指數評估腸道微生物群的α多 樣性。與NCD-PBS組相比,我們觀察到HFD-PBS組的α多樣性指數顯著降低(p<0.05;圖4A)。然而,與SDF和CB的聯合幹預導緻香農和辛普森指數顯著增加(p<0.05)。值得注意的是,這三項指标在HFD-CB和HFD-SDF組中并不顯著。我們通過線性判别分析效應大小(LEfSe)比較了五組中的腸道微生物群,以确定不同組中的特定微生物群(圖4B和C)。與NCD喂養的小鼠相比,HFD喂養的小鼠中梭狀芽孢杆菌UCG-014的相對豐度顯著降低 。然而,在HFD-SC組中,其他梭菌(Vadinb60梭菌)的相對豐度顯著增加。這一發現表明,與SDF和CB的聯合幹預成功地促進了CB腸道定植。此外,乙酰化因子、氣味細菌、糞便杆菌和腸杆菌(其成員已知爲丁酸生産者)在HFD-SDF、HFD-CB或HFD-SC組中更爲豐富。總之,這些結果表明,與SDF和CB的聯合幹預改善了HFD誘導的腸道微生物群紊亂,并增加了丁酸産生菌的數量。
3.5 SDF和CB聯合幹預改善HFD誘導的腸道粘膜屏障損傷
鑒于轉錄組測序的結果,我們接下來試圖确定SD F和CB對腸粘膜的影響。腸絨毛不僅被認爲是一種天然的保護屏障,而且是消化和營養吸收的主要場所。事實上,腸絨毛是脂質代謝和内毒素血症的關鍵因素。腸絨毛長度和表面的增加與營養素的吸收率有關。因此,腸絨毛長寬比通常用于評估腸道生長和功能。我們檢查了小腸的組織形态學和長寬比,以确定CB和/或SDF治療的效果。H&E染色顯示,與N CD 喂養的小鼠相比,H FD 喂養的小鼠的絨毛長度和隐窩深度顯著減少(圖5A )。然而,在H FD 喂養的小鼠中,H FD -PBS組的腸絨毛長寬比顯著低于其他組(圖5B)。緊密連接蛋白是腸粘膜屏障的結構基礎。對所有組的小腸組織進行蛋白質印迹,以檢測緊密連接相關蛋白的表達(圖5C )。蛋白質豐度圖 5:SDF 和 CB 的聯合幹預改善了腸道粘膜的完整性。( A ) H & E 染色( 100× )小腸切片的代表性圖片。( B )絨毛長寬比。( C )腸道緊密連接蛋白的代表性免疫印迹分析。( D )緊密連接蛋白豐度的定量分析。( E )L02 細胞中MitoSOX染色的代表性圖像。數據以平均值±标準差表示,每組n=2–7。 a: p<0.05 ;與 NCD-PBS 相比, b:p<0.05 ;與 HFD-PBS 相比;c:p<0.05 ;與HFD-CB相比; d:p<0.05;與HFD-SDF相比; e:p<0.05 ;與HFD-SC相比。HFD-PBS組的claudin-4、claudin-1和ocludin顯著低于其他四組(圖5D )。此外,在HFD-SC 組中觀察到緊密連接相關蛋白的最高表達。上述數據表明,與SDF和CB的聯合幹預改善了腸道粘膜屏障的結構和功能。

圖 5:SDF 和 CB 的聯合幹預改善了腸道粘膜的完整性。(A)H&E染色(100×)小腸切片的代表性圖片。(B)絨毛長寬比。(C)腸道緊密連接蛋白的代表性免疫印迹分析。(D)緊密連接蛋白豐度的定量分析。(E)L02 細胞中MitoSOX染色的代表性圖像。數據以平均值 ± 标準差表示,每組n=2–7 。 a:p<0.05 ;與NCD-PBS 相比,b:p<0.05 ;與HFD-PBS 相比;c : p<0.05 ;與HFD-CB相比; d:p<0.05 ;與 HFD-SDF 相比; e:p<0.05 ;與HFD-SC相比。
3.6 SDF和CB聯合幹預改善HFD誘導的氧化應激和脂質代謝功能障礙
轉錄組測序結果表明,HFD通過氧化應激和脂質代謝功能障礙誘導MAFLD。爲了研究聯合幹預是否通過調節與脂質代謝和抗氧化應激相關的基因表達來改善MAFLD ,我們重點研究了上述信号通路中的核心蛋白。乙酰輔酶A羧化酶(ACC )和ATP檸檬酸裂解酶(Acly)是催化脂肪酸合成的限速酶。 Nrf2是氧化應激信号的主要調節因子。結果表明,聯合幹預減少了H FD 誘導的Acly和ACC 磷酸化(圖6A和B)。與其他脂質合成相關的蛋白質在HFD-SC組也明顯減少,包括脂質1、脂肪酸合酶(FASN )、酰基輔酶A合成酶(ACSL1)和細胞質乙酰輔酶A合成酶(AceCS1)。然而,在HFD-CB和HFD-SDF組中,我們沒有發現這些蛋白質有明顯變化。除了高效的脂肪酸氧化外,氧化應激也是MAFLD的一個普遍特征。Nrf2是細胞抵抗氧化應激的中央防禦蛋白。因此,我們探讨了聯合幹預在Nrf2表達中的作用。值得注意的是,結果表明,聯合幹預誘導了Nrf2、Keap1和超氧化物歧化酶(SOD)的表達(圖6C和D )。丁酸鹽是CB從SDF中提取的重要代謝産物。爲了證實丁酸的影響,我們在L02細胞中使用PA誘導的MAFLD,但在Masson染色中未發現任何明顯變化。接下來,我們分析了不同丁酸濃度下的蛋白質和活性氧水平。一直以來,丁酸降低了Acly和ACC磷酸化,激發了Nrf2活性并抑制了脂質合成(圖6E和F)。從曆史上看,減少活性氧是限制與氧化應激相關的細胞損傷的關鍵。丁酸劑量依賴性地降低L02細胞中的ROS水平(圖5E)。總之,這些結果表明丁酸可能是改善MAFLD的關鍵。
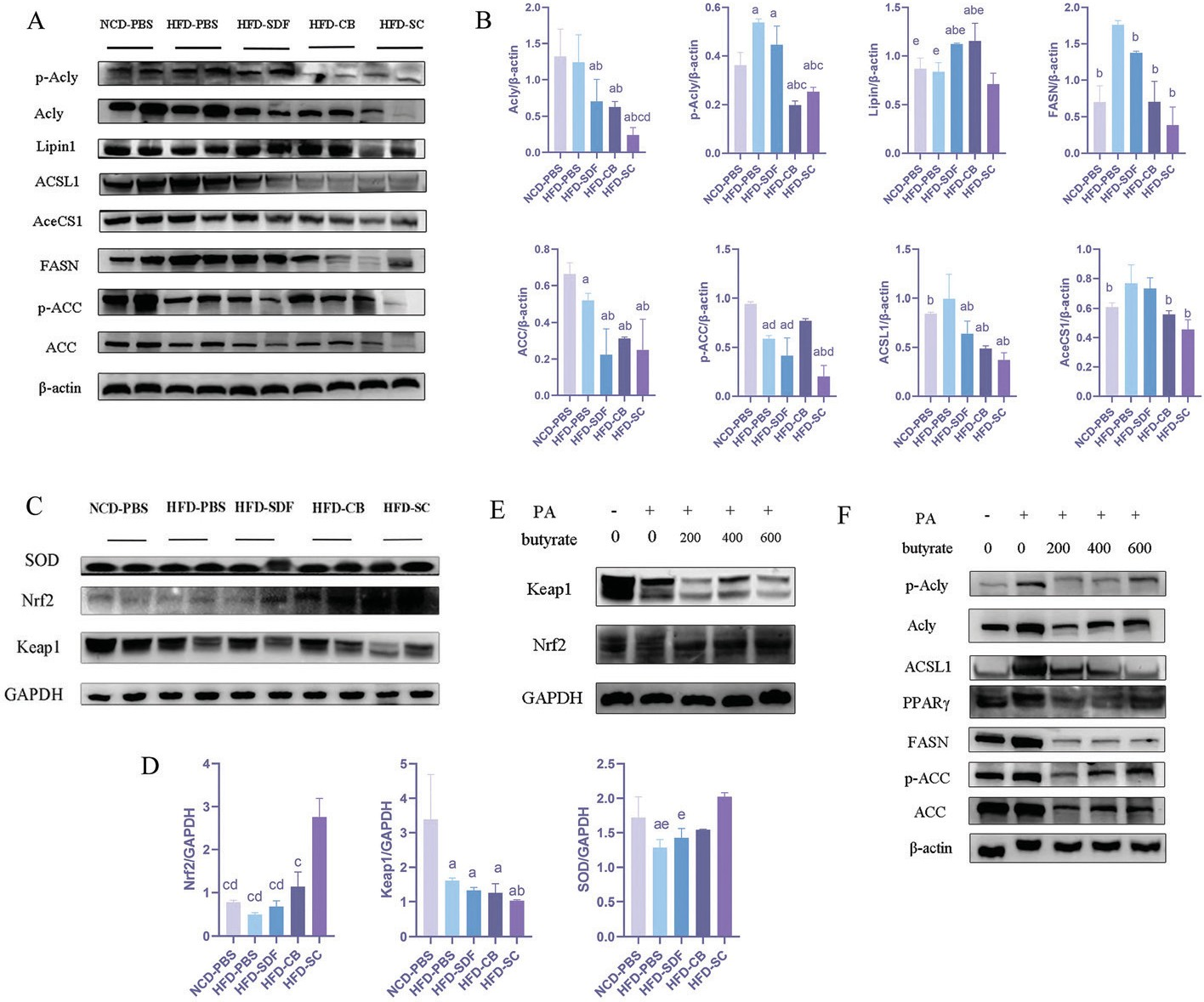
圖6 SDF和CB的聯合幹預改善了脂質代謝和氧化應激。(A)肝髒中脂肪酸和脂質代謝蛋白的代表性免疫印迹分析。(B)脂肪酸和脂質代謝蛋白質豐度的定量分析。(C)肝髒中 Nrf2/Keap1 信号通路和 SOD 蛋白的代表性免疫印迹分析。(D)Nrf2/Keap1 信号通路和 SOD 蛋白豐度的定量分析。(E)L02 細胞中 Nrf2/Keap1 信号通路蛋白的代表性免疫印迹分析。(F) L02 細胞中脂肪酸和脂質代謝蛋白的代表性免疫印迹分析。數據以平均值 ± 标準差表示,每組 n=2 。 a:p<0.05;與 NCD-PBS相比,b:p<0.05;與 HFD-PBS相比;c:p<0.05 ;與HFD-CB相比;d:p<0.05;與HFD-SDF相比; e:p<0.05 ;與HFD-SC相比。
【讨論】
普遍認爲,氧化應激、腸道微生物群紊亂和肝髒脂質代謝功能障礙在MAFLD發病機制中起關鍵作用。我們的結果表明,SDF和CB的影響存在個體差異。由于這些個體差異,很難評估SDF和CB在MAFLD中的作用。相反,SDF和CB的聯合幹預有效地保護了腸道完整性,降低了體重和血脂沉積和全身炎症,并增加微生物多樣性。這些結果表明,通過針對腸道微生物群調節脂質代謝、氧化應激和炎症,與SDF和CB的聯合幹預對MAFLD 具有積極作用。MAFLD 患者通常伴有腸道微生物群失調和産生LPS的細菌增多。高脂肪飲食會導緻血清LPS水平過高,進而通過減少緊密連接蛋白(claudin1、claudin4和ocludin)破壞腸粘膜完整性,并誘導腸上皮細胞凋亡。LPS-CD14複合物觸發TLR4激活巨噬細胞,激活NF-κB信号通路和随後的N LRP3激活,誘導産生促炎細胞因子,如TNF-α、IFN -γ、IL-6和IL-1β。此外,100納克/毫升LPS和20納克/毫升IFN -γ刺激巨噬細胞M 1極化,然後瀑布效應和釋放氧自由基。因此,LPS和M1巨噬細胞形成炎症正反饋環。CB通過發酵SDF産生丁酸和其他短鏈脂肪酸參與抗炎作用。同時,丁酸在線粒體中被有效吸收和氧化爲乙酰輔酶a,作爲腸上皮細胞的直接能源。此外,丁酸可以穩定缺氧誘導因子,進而增強上皮屏障功能。在線粒體基質中,脂肪酸β-氧化将脂肪酸轉化爲乙酰輔酶A。随後,乙酰輔酶A 通過三羧酸循環和氧化磷酸化氧化生成ATP。然而,ACC催化乙酰輔酶A轉化爲丙二酰輔酶A ,這是脂肪酸合成的第一步。ACC是AMPK的直接下遊激酶。AMPK在ACC中Ser79處的磷酸化降低了ACC的酶活性。AMP/ATP比率的增加是AMPK激活的主要機制。乙酰輔酶A反式酯酶犧牲一個乙酰輔酶A來激活丁酸鹽。值得注意的是,丁酸加速ATP消耗,并通過增加AMP/ATP的比率激活AMPK。這可能是聯合幹預導緻AMPK激活和防止肝髒脂質積聚的原因。近年來,許多研究強調氧化應激促進NAFLD進展爲NASH 。腸上皮細胞和腸道微生物群之間的相互作用誘導宿主細胞産生ROS。與LPS一起,ROS促進TLR4基因表達增加,進一步激活M1巨噬細胞誘導的炎症。此外,炎症促進持續氧化應激并導緻線粒體功能障礙。在這種情況下,線粒體呼吸鏈疾病的特征是電子洩漏,導緻活性氧的積累。以前的研究表明,肝損傷期間巨噬細胞的極化導緻代謝重組,其特征是炎症小體激活和乳酸和活性氧的産生增加。抗氧化劑抑制TLR4/N F-κB信号通路的激活可以有效抑制炎症小體的激活,和M1巨噬細胞的極化。上文描述了HFD-PBS和HFD-SC組之間差異基因的GO分析。結果清楚地表明,許多與線粒體功能相關的基因顯著富集,例如“呼吸鏈”、“線粒體内膜”、“氧化還原酶複合體/活性”、“過氧化物酶活性”和“抗氧化活性”。值得注意的是,聯合幹預可以激活Nrf2-Keap1信号通路,導緻随後的抗氧化反應激活。Nrf2-Keap1信号通路是第二階段抗氧化基因的主要激活因子,如SOD、CAT、GST、HO-1和NQO1.益生菌作爲改善健康和預防疾病的手段疾病正面臨殖民化的挑戰。在我們的研究中,與SDF和CB的聯合幹預改善了MAFLD ,然而,與SDF或CB的單一幹預并沒有産生預期的結果。一個合理的解釋是,SDF作爲細菌發酵的基質有助于爲炭黑的萌發和定植創造有利的環境。此外,丁酸還通過抑制炎症、維持腸粘膜完整性、和促進脂肪酸β氧化在改善MAFLD 中發揮重要作用。然而,一些研究報告稱,低聚木糖和卟啉衍生低聚糖ides82可緩解小鼠MAFLD 和相關腸道微生物群失調。相反,VishalSingh等人發現,長期食用可溶性纖維菊糖、果膠或低聚果糖會導緻小鼠腸道微生物群失調和肝髒疾病(膽汁淤積、肝髒炎症和肝癌)。可持續發展框架有多種,不同的可持續發展框架有不同的影響。是否有細菌專門利用SDF,單一或混合類型的SD F的影響以及不同類型的SD F對腸道微生物功能、宿主健康和代謝的影響仍不清楚。在新食品和藥品的開發過程中,益生菌和SDF的選擇是食品和醫療行業面臨的挑戰。
【結論】
我們已經确定,與SD F和C B的聯合幹預可以抑制M 1巨噬細胞的激活,防止H FD 誘導的慢性炎症,并促進脂質代謝。機制研究表明,共同幹預改善了線粒體功能通過激活Acly/Nrf2/NF-κB信号通路來實現,該信号通路介導抗氧化能力和脂質代謝活性的增加,從而降低LPS、RO S和炎症反應的水平。與SD F和C B的聯合幹預爲進一步發展微生物群靶向幹預治療和臨床應用帶來了巨大希望。


