結直腸癌(Colorectal cancer, CRC)是全世界範圍内與癌症相關死亡的第二大主要原因,尤其是在50歲以下的個體中其患病率正逐步攀升。CRC作爲腸道上皮的異質性疾病,其特征在于突變的累積和免疫反應的失調。越來越多的證據表明,高達90%的疾病風險是由飲食等環境因素所緻,這與近些年來提出CRC相關“緻癌菌群”的文獻報道相一緻。然而,與衆所周知的幽門螺杆菌在胃癌中的因果作用不同,目前尚未鑒定觸發CRC的特定微生物。這種腸道菌群失調是導緻CRC的直接原因還是僅僅代表“旁觀者效應(bystander effect)”尚不清楚。因此,破譯驅動CRC的特定緻病菌群或代謝産物并表征其潛在機制十分必要。 近日,來自牛津大學的Fiona Powrie課題組在Nature 雜志上發表了一篇題爲“Host–microbiota maladaptation in colorectal cancer” 的綜述,系統回顧了截至目前已報道的CRC中宿主與腸道菌群的相互作用,重點分析與腸道屏障破壞,基因毒性和炎症反應的有關機制,這一領域存在的未知和挑戰以及新興技術的應對策略。

一、宿主建立對腸道菌群的防禦屏障
長期以來,哺乳動物結腸與多樣化的微生物生态系統共同進化,在一定程度上通過在宿主中形成強大的免疫系統,以促進宿主和微生物群落的互利共赢。維持這種平衡的關鍵是腸道上皮細胞(intestinal epithelial cells, IEC),它們在宿主-菌群交界面上形成單層物理屏障,并由位于腸隐窩(intestinal crypts)中的多能性腸幹細胞(multipotent intestinal stem cells)不斷給予補充。IEC的增殖受幹細胞龛(stem cell niche)的調節,并涉及底層間充質的旁分泌信号傳導,而上皮間緊密連接蛋白與保護性粘蛋白的分泌協同增強屏障的完整性。
除去物理屏障的作用,IEC還通過模式識别受體來感知微生物群。這些受體的刺激促進上皮細胞修複和緊密連接蛋白的上調,并觸發将信号傳遞至固有層細胞的多種細胞因子産生。至關重要的是,上皮細胞并非獨立存在,而是與免疫細胞和間充質一起形成“三元組(triad)”。如果微生物或其産物破壞了上皮屏障防線,那麽免疫細胞和間充質細胞将通過啓動一系列支持上皮完整性的信号網絡來充當第二道防禦線。例如,NF-κB和STAT3通過的激活可以觸發支持體内穩态組織修複生長因子和細胞因子的産生。盡管間充質細胞是動态的,并且對于維持體内平衡至關重要,但是需要進一步的工作來确認它們是否與微生物群存在直接相互作用。
二、CRC的危險因素
雖然尚未揪出CRC的真正緻病元兇,但已有大量證據指出相關危險因素。與炎症性腸病(inflammatory bowel disease, IBD)相關的炎症,以及遺傳性基因缺陷如家族性腺瘤性息肉病和Lynch綜合征是已知的遺傳危險因素;數學建模将70-90%的風險歸因于環境因素,尤其是纖維含量低而紅肉含量高的飲食習慣;此外,緻病性感染也是公認的環境觸發因素,例如于1991年發現的幽門螺杆菌與胃癌的聯系。當然,無論CRC的始發因素是什麽,通常都涉及體内穩态免疫和微生物群衍生信号的破壞,刺激産生上皮細胞過度修複的反應。這類反應往往會導緻腸道幹細胞内一連串基因突變諸如APC,KRAS或PIK3CA,以起始腫瘤發生。
腸道炎症被認爲是CRC中的“雙刃劍”。原位T細胞的數量與CRC積極的臨床結局相關,利用免疫系統進行抗原特異性清除仍然是許多治療策略的目标。然而,腫瘤通常通過免疫編輯腫瘤抗原而逃避這種免疫介導的破壞,使其無法被檢測到。盡管先天性免疫細胞(例如中性粒細胞和巨噬細胞)可以幫助清除腫瘤,但在某些情況下,它們會釋放活性氧,這可能通過破壞IECs的基因組完整性來引發緻癌級聯反應。因此,腫瘤細胞創建了一個惡性循環,其中微環境中的許多細胞(包括駐留的成纖維細胞)可以被重新編程以産生額外的生長因子,細胞因子和促血管生成因子,從而維持不受限的增殖和侵襲。
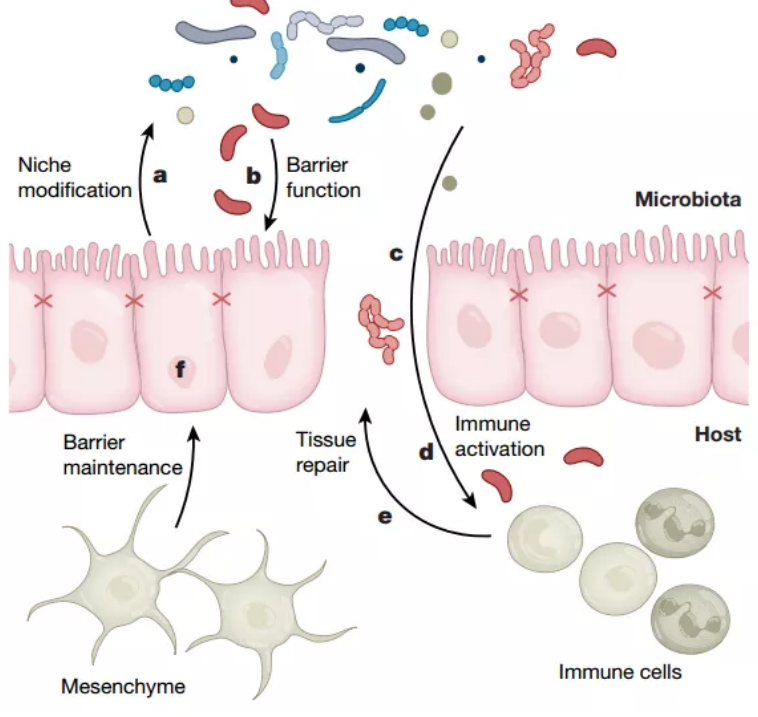
圖1,健康個體和CRC個體中宿主與腸道菌群相互作用示意圖
三、CRC患者往往伴随腸道菌群失調
CRC中宿主與菌群的相互作用關系被初步證明于1975年,當時觀察到緻病性二甲基肼在無菌大鼠中誘發的結腸腫瘤明顯少于腸道菌群正常的大鼠。此外,相對于接受健康菌群的小鼠而言,接受CRC糞便菌群的小鼠腸息肉數量更多。由于包括16S rRNA和鳥槍法宏基因組學(shotgun metagenomics)在内的微生物組分析技術的發展,與健康對照個體相比,CRC患者的腸道菌群成分有差異是無可厚非的,被概括爲“菌群失調”。在CRC腫瘤組織中檢測出較高含量的核梭菌、大腸埃希氏菌、脆弱拟杆菌、糞腸球菌、解脲鏈球菌和消化鏈球菌菌種,而所謂的保護性菌屬包括羅氏菌、梭菌、費卡杆菌和雙歧杆菌在内的細菌數量明顯減少。這些差異中的一些(梭菌水平最一緻)與臨床結局和化療敏感性相關,因此這類細菌具有作爲生物标記物的潛力。然而,這種菌群類型和數量的變化究竟是癌症的原因還是結果,是否能将CRC的發生歸因于某些特定的“緻癌”微生物,仍具有挑戰性。
四、CRC相關菌群可緻基因毒性
如果要定義單個微生物或群落具有緻癌性,那麽它們必須發揮緻癌作用,比如DNA損傷。近期有許多研究報道了與CRC相關的基因毒性,其中包括産大腸菌素的聚酮化合物合酶(pks)+大腸杆菌(以下簡寫爲pks+E.coli),腸毒性脆弱性雙歧杆菌(ETBF),糞腸球菌和産生細胞擴張毒素的空腸彎曲菌。尤其是pks+E.coli可緻雙鏈斷裂,異倍體型和不正确的細胞分裂。在具有遺傳易感性的Il10-/-小鼠中,pks+E.coli和ETBF可以誘導8-氧代鳥嘌呤DNA損傷,這些損傷與結腸腫瘤的發生率具有很高的相關性。ETBF毒素可以上調精胺氧化酶水平,從而導緻活性氧的産生和DNA損傷标記γ-H2A.x的誘導。
五、腸道菌群驅動的代謝物的影響
盡管飲食可以直接緻癌,它同樣也可以通過改變特定物種的豐度和代謝物來影響腸道生态系統。例如,與高硫代謝細菌水平增加相關的飲食與遠端結腸癌和直腸癌的風險增加相關;高脂飲食與CRC的複發以及某些微生物的膠原蛋白水解活性相關。爲鑒定與CRC相關的候選代謝物,已有研究針對Lynch綜合征和CRC患者的糞便進行了蛋白質組學分析。這些研究确定了氧化代謝微環境的增強,這被認爲是由于CRC患者結腸中活性氧和活性氮的含量增加以及破壞DNA的膽汁酸脫氧膽酸的濃度增加。在缺少遊離脂肪酸受體2(FFAR2)的小鼠中觀察到腫瘤發生增加,這被認爲是由于IEC完整性降低,細菌大量湧入,樹突狀細胞過度活化以及CD8 + T細胞表型耗竭所緻。
六、炎症反應在CRC中的作用
炎症是結直腸癌發生的公認驅動因素,因此患有IBD的個體患CRC的風險增加。然而,菌群塑造腫瘤免疫環境的途徑,進而改變周圍微生物群的方式,是正在進行的研究的重點。腸道上皮屏障的破壞使得被分隔的微生物流入組織。有研究報道,缺乏模式識别受體相關基因Nod1,Nod2和Ripk2的小鼠腫瘤多樣性和IEC通透性增強,強調宿主防禦和IEC功能在預防腫瘤發生中的重要性。
由腸道屏障缺陷導緻的細菌轉移與多種癌症相關促炎因子的産生相關,包括IL-1β,IL-23,IL-22,IL-27,尤其是IL-17A和IL-6。與此相一緻,在小鼠和人類中,發現有細菌浸潤的腫瘤中,IL-6,IL-23和IL-17A的表達均發生上調。此外,IL-6與IEC上的受體結合以觸發異常增殖。此外,受體表達模式的重要性通過一項研究得到例證,該研究表明,IL-1受體的CD4+ T細胞特異性消融減少了腫瘤誘發的炎症反應,而髓樣細胞該受體的缺乏則會增加細菌入侵和IL-17A分泌,以及增殖腫瘤的數量和大小。
值得注意的是,許多細胞因子在CRC中顯示多效性功能。例如,已知由菌群觸發并由T細胞和固有淋巴樣細胞産生的IL-22可以維持IEC增殖并在炎症過程中誘導抗凋亡蛋白的表達(促腫瘤發生的作用),但也可以在基因毒性損傷後,誘導屏障完整性和DNA損傷修複(抗腫瘤發生的作用)。當然,這些機制中的部分結論是從使用小鼠适應性病原體(例如肝螺杆菌)的模型系統中獲得的。細胞因子在緻癌過程中的不同作用取決于它們在疾病進展過程中的濃度和時間動态性,以及其他細胞類型,細胞因子等背景,而這些變量經常在許多還原研究中被忽略。

圖2,腸道菌群促成CRC的已知炎症機制
七、炎症驅動的微生物生态位
對IBD的研究已經說明,不受控制的炎症會在結腸内産生不同的生态位(ecological niche),從而導緻更适應的菌群存活。盡管這通常被認爲是有害的,但這種細微差别的過程可能在進化上很重要。
特定“緻癌”物種的豐富程度似乎部分取決于抗炎細胞因子IL-10,這說明了緻癌過程中免疫适應不良的有害後果。的确,在IL-10敲除小鼠的腸中觀察到基因毒性的pks+E.coli數量增加,且IL-10缺失與拟杆菌屬,普氏杆菌屬和裏克氏菌屬增加的豐度相一緻。重要的是,菌群可以例如通過産生丁酸鹽以反饋從而改變IL-10的水平。丁酸酯特異性受體GPR109A的下遊信号可以抑制炎症驅動的緻癌作用,并使巨噬細胞和樹突狀細胞使CD4+ T細胞偏向産生IL-10的T調節細胞。類似于IL-10,IL-33的缺失也會增強對炎症驅動的結腸癌的敏感性。值得注意的是,将IL-18缺陷型和野生型小鼠共居以實現菌群轉移,這一操作引起野生型小鼠中炎症誘導的CRC患病率增加。相反,一些研究報道IL-18可能通過抑制産粘液的杯狀細胞成熟來促進DSS誘導的結腸炎。這些看似矛盾的數據也可能是由于不同的時空因素,劑量因素等造成,但關于這點還未能得到明确結論。
八、“緻癌微生物”引起免疫成分改變
腫瘤可以通過募集特定的免疫細胞來創建适宜腫瘤生長的微環境,其密度和成分能被菌群所影響。例如,吸引淋巴細胞的趨化因子CCL5、CCL20和CXCL11的水平與拟杆菌和厚壁菌門的成員相關,并且可以在體外被具核梭杆菌和大腸杆菌誘導。然而,這些化學誘導物是否募集保護性或緻病性T細胞亞群尚不清楚,可能會受到基因背景的影響,在IECs中缺乏自噬調節基因Atg7的小鼠中,菌群與細胞毒性CD8+ T細胞和CD4+ TH1反應相關。因此,改變菌群以使其傾向于“熱”腫瘤微環境(通常以浸潤CD8+ T細胞和患者有益的結果爲特征)将是一種有趣的治療方案。
ETBF已被發現會在ApcMin /+小鼠中由STAT3激活驅動誘發促癌TH17的反應。這伴随着iNoshigh單核細胞樣髓樣來源的抑制細胞(M-MDSCs)的募集和分化,腫瘤内IL-17A與IL-17R +髓樣細胞結合驅動Nos2上調。這些M-MDSC抑制了細胞毒性CD8 + T細胞的活性,同時誘導了涉及腫瘤生長(Mmp9)和血管生成(Vegfa)的基因表達。
與ETBF相似,在DSS誘導的CRC小鼠模型中用CRC相關溶脂鏈球菌進行管飼會導緻腫瘤負荷增加,免疫抑制性CD11b +髓樣細胞的選擇性募集和髓樣來源的細胞因子(包括IL-6和IL-8)水平升高。喂食具核梭杆菌的ApcMin / +小鼠的腫瘤負荷更大,同時伴随着免疫抑制性瘤内髓樣細胞的增多。據報道,與CRC相關的厭氧消化鏈球菌可通過選擇性粘附于結腸癌細胞并誘導NF-κb來觸發ApcMin / +小鼠中促腫瘤髓細胞群體的擴張,以及T調節細胞,TH17和細胞毒性CD8 + T細胞頻率同時增加。具核梭杆菌還可以以不依賴細胞因子的方式起作用,并直接抑制自然殺傷細胞的細胞毒性,從而使腫瘤能夠逃避免疫系統追殺。用具核梭杆菌預處理CRC細胞系通過受體TIGIT與具核梭杆菌衍生蛋白Fap2的結合降低了共培養的NK細胞的活性。
九、研究“緻癌微生物”的新興技術
綜上所述,盡管在這一領域已經取得了實質性的進展,但尚且缺乏關于改變的菌群與宿主之間在治療上存在因果作用的證據。編撰一部完整的與CRC相關的包括細菌、真菌、病毒、古細菌和代謝物的豐度和功能菌群譜,并考慮這些因素與宿主之間的多層串擾是一項尚待解決的艱巨任務,而這部分是由于測序深度的限制,特定菌種難以培養以及複現人類腫瘤微環境模型的局限性等。
首先,類器官是上皮組織的三維培養系統,可在體外穩定培養源自患者的腫瘤組織。通過使用該技術,可以測試各種刺激效果,但是對類器官封閉頂端表面的接近性較差,使得具有菌群成分的培養具有挑戰性。緊接着,細菌的類器官内顯微注射技術的發展和上皮極性逆轉的研究已經開始解決這個問題。例如,将pks+E.coli注射至類器官中揭示了這種細菌直接引起臨床相關的CRC驅動突變的能力。盡管這種還原論方法有自己的價值,但重要的是要了解緻病菌群對基因背景以及來自腫瘤微環境的其他細胞起作用的能力。因此,科研人員将類器官實驗擴展到與免疫細胞和間充質細胞共培養,使用CRISPR–Cas9引入靶向突變。
進一步的,科研人員開發了一種稱爲“器官芯片(organ-on-a-chip)”的體外微流系統,該系統利用特定的通道滲透性整合了多個細胞元素。這種微流體模型稱爲“HuMIX”,通過共培養營養物質,活微生物和人上皮細胞來産生獨特的短鏈脂肪酸(short-chain fatty acids, SCFAs)比率,限制IECs的自我更新能力,從而提供了與CRC相關代謝産物的功能性見解。重要的是,該技術已經擴展到可以對厭氧和好氧菌群進行建模,這些進展還将有助于研究微生物内部對必需營養素的競争,可能與緻癌微生物的生長相關。
基因工程小鼠模型(Genetically engineered mouse models, GEMM)構成了這篇綜述中讨論的許多研究的基礎。然而,一些模型潛伏期較長且不能複現人類疾病的晚期階段。爲了減少模型的持續時間,從而在不發生細菌抗藥性的情況下進行抗生素處理,可以将緻瘤類器官局部注入實驗動物的直腸。對于在體内還原微生物-宿主相互作用的複雜性以及證明CRC的緻病因果關系。爲了研究晚期CRC,已經設計出轉移模型,并提供了工具來研究菌群在調節上皮-間質轉化中的潛在作用。
值得注意的是,盡管抗生素是在疾病發展過程中調節微生物群的有用工具,但它們通常針對某些微生物而沒有足夠的控制或确保根除,從而使數據解釋具有挑戰性。例如,在DSS-乙氧基甲烷癌症模型中,在無菌小鼠中觀察到增強的腫瘤發生,有趣的是,使用抗生素處理的結果卻相反。這種看似相反的數據可能是由于具有抗生素抗性菌群的存在,或消除菌群的時間點不同再或者無菌小鼠的免疫系統不同等因素。除細菌和代謝産物外,有越來越多的證據表明真菌,古細菌和病毒也在CRC中發生改變。最近有通過真菌共生體誘導IL-18可抑制結腸炎相關的小鼠CRC,從而突顯其保護性作用。
對于這樣的集成分析流水線,廣泛而系統的“多組學(multi-omic)”方法對于構建交互組(interactome)至關重要,另一個新興領域是在菌群背景下對表觀遺傳學進行分析,例如與CRC腫瘤中獨特的甲基化模式相關的梭杆菌屬。當然,鑒于模型系統之間存在廣泛的個體異質性和局限性,因此大規模國際患者隊列(包括有關宿主的菌群和遺傳特征的綜合數據)對于确定臨床相關發現至關重要。
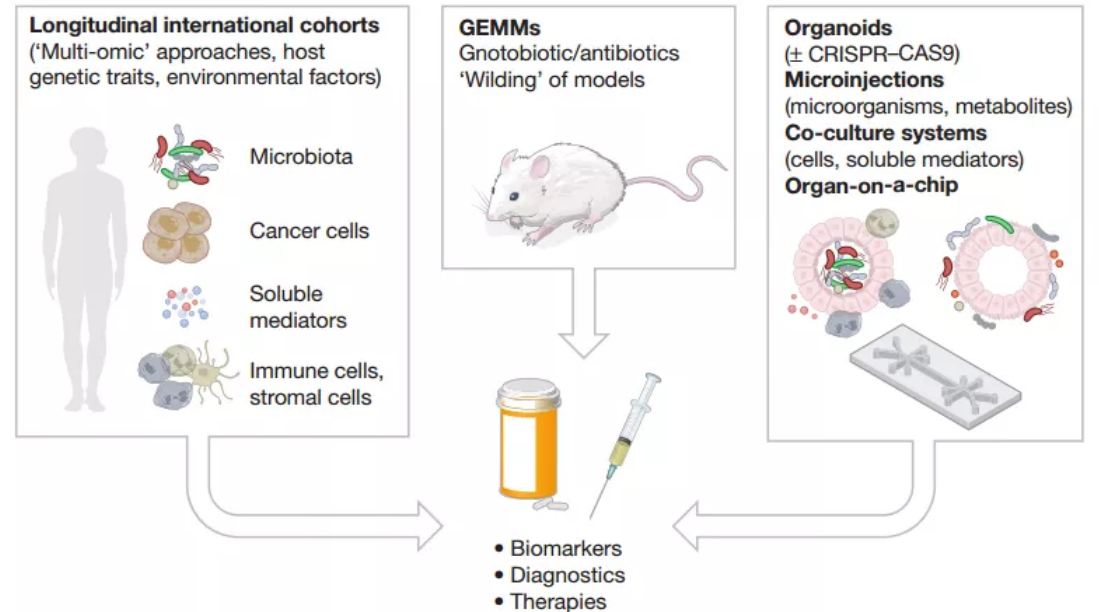
圖3,研究腸道菌群在CRC中緻病作用的方法學
讨論
在過去的十年中迅速累積的研究發現,早期癌前病變的個體與轉移性CRC個體的腸道菌群組成存在差異。在CRC中鑒定出的具核梭杆菌,大腸杆菌或脆弱拟杆菌的豐度增加,開創了腫瘤研究的新領域,即微生物可以作爲生物标記物與常規診斷方法結合使用。靶向菌群的治療方法也正在興起,包括選擇性消除緻癌菌群,糞便移植抗緻癌菌群以及通過口服補充劑或靶向噬菌體療法使微生物群傾斜。然而,由于微生物組對宿主生物學的多種作用,因此需要謹慎考慮上述治療手段是否存在副作用。
非常重要的是,當前必須破譯某一特定菌株或“緻癌”菌群(包括細菌,真菌,病毒,古細菌及其産生的代謝産物)的聯合是否會改變疾病狀态。由于微生物群中個體内部的異質性很大,那麽可以認爲,不同個體中的不同菌株将通過共同途徑以觸發相似的病理改變,因此,針對廣泛而非特定的單元研究可能是最有效的策略。
總而言之,這篇綜述已經向我們展示了截至目前針對腸道菌群對宿主CRC的各種可能機制,從改變腸道屏障和/或免疫環境到重塑結腸生态位和提供基因毒性損傷等。盡管宿主的适應不良和屏障破壞對于促進宿主與微生物群之間的緊密接觸非常關鍵,但仍需要縱向多組學來解釋這些“階段”在腫瘤發展中的時間順序。當然,非常幸運的是,目前已有大批新興技術爲在模拟生理CRC系統的背景下研究微生物群,這對于破解結腸腫瘤微環境的挑戰性和複雜性提供可能。
原文鏈接:https://doi.org/10.1038/s41586-020-2729-3


